Les infections intracellulaires représentent un problème important de santé publique ; elles sont souvent résistantes car les bactéries survivent au milieu intracellulaire en adoptant des mécanismes ingénieux, comme l’inhibition de la fusion phagosome-lysosome, la résistance à l’attaque des enzymes lysosomales ou aux radicaux libres. Elles s’échappent ainsi du phagosome pour coloniser le cytoplasme cellulaire. C’est le cas, par exemple, des bactéries intracellulaires facultatives comme Salmonella typhymurium, Listeria monocytogenes ou Mycobacterium tuberculosis [1]. Les bactéries intracellulaires se retrouvent le plus souvent dans les cellules phagocytaires qui peuvent constituer de véritables réservoirs de pathogènes et infecter d’autres tissus, entraînant la récurrence d’infections systémiques. Le traitement de ces infections intracellulaires est souvent difficile en raison d’une pharmacocinétique inadaptée à la localisation de ces pathogènes. Pour être efficace, l’antibiotique doit, en effet, répondre à de nombreux critères qui sont rarement satisfaits : (i) être capable de pénétrer au niveau intracellulaire, (ii) avoir un temps de rétention intracellulaire suffisamment long, (iii) se distribuer au niveau des compartiments infectés (phagosomes, endosomes ou lysosomes) et (iv) être capable de développer son activité antibactérienne dans ces compartiments. À noter que ceux-ci se caractérisent souvent par un environnement peu favorable à l’activité antimicrobienne (pH acide, présence de cocktails enzymatiques agressifs, etc.). Mauvaise pénétration dans les cellules et diminution de l’activité antibiotique intracellulaire sont donc les principales raisons de la résistance aux antibiotiques. À noter que le rapport des concentrations intracellulaires et extracellulaires est souvent utilisé pour classer la capacité d’accumulation intraphagocytaire des médicaments antimicrobiens. Ainsi, la pénicilline et l’ampicilline qui sont des acides faibles ionisés au pH extracellulaire, diffusent mal à l’intérieur des cellules, tandis que les aminoglycosides s’accumulent bien dans les endo-lysosomes mais au pH acide de ces organites intracellulaires, ils sont peu actifs. D’autres antibiotiques diffusent correctement à l’intérieur des cellules mais leur temps de résidence y est limité, leur vitesse d’entrée dans la cellule étant équivalente à leur vitesse de sortie. Une difficulté supplémentaire résulte du fait que de nombreuses bactéries intracellulaires sont dormantes au sein d’un environnement agressif et elles peuvent donc persister pendant de longues périodes sans se diviser, ce qui a pour effet de diminuer considérablement leur sensibilité aux antibiotiques. Enfin, au niveau tissulaire, les propriétés d’adhésion des bactéries qui s’expriment via le glycocalyx favorisent la formation de biofilms peu perméables aux antibiotiques. Force est de constater que plus de deux tiers des antibiotiques prescrits sont inefficaces contre les agents pathogènes intracellulaires.
L’idée a donc émergé d’utiliser des nanovecteurs pour transporter les antibiotiques au niveau des compartiments intracellulaires infectés [2] (Figure 1). Caractérisés par une taille d’une centaine de nanomètres, ils sont environ 70 fois plus petits que les globules rouges. Ils sont captés par les cellules via un mécanisme de phagocytose ou d’endocytose (souvent médiée par la clathrine) et se concentrent donc dans les compartiments phago-lysosomiaux en suivant un cheminement très comparable à celui des bactéries et/ou des virus [3] (Figure 1). Ces nanovecteurs sont préparés par des méthodes physico-chimiques très variées en utilisant : (i) des lipides comme pour la construction des liposomes, petites vésicules constituées de bicouches de phospholipides alternant avec un compartiment aqueux ou (ii) des polymères biodégradables pour l’obtention de nanoparticules (à base de polyalkylcyanoacrylates ou d’acides polylactiques-co-glycoliques) ou de micelles (à base de polymères amphiphiles contenant souvent du polyéthylène-glycol). L’antibiotique est généralement encapsulé en utilisant des méthodes physiques qui aboutissent à l’adsorption de la molécule active à la surface du nanovecteur ou, dans les meilleurs cas, à son piégeage moléculaire au sein de la nanoparticule. Plus récemment, des méthodes chimiques ont permis l’obtention de nanomédicaments en couplant l’antibiotique à un lipide (le squalène), via une liaison sensible à l’acidité ou aux enzymes présents au niveau des lysosomes [4]. De cette manière, l’antibiotique peut être libéré sélectivement dans les compartiments endocellulaires infectés (Figure 1). De plus, dans les infections intracellulaires, les agents pathogènes s’abritent principalement dans le système des phagocytes mononucléaires (SPM), constitué principalement de monocytes sanguins et de macrophages tissulaires hépatiques (cellules de Kupffer) ou spléniques. Or, après administration intraveineuse, les liposomes et les nanoparticules sont reconnus comme des particules exogènes ; elles sont opsonisées en activant le complément, et sont captées sélectivement par le système des phagocytes mononucléaires où persistent les agents pathogènes.
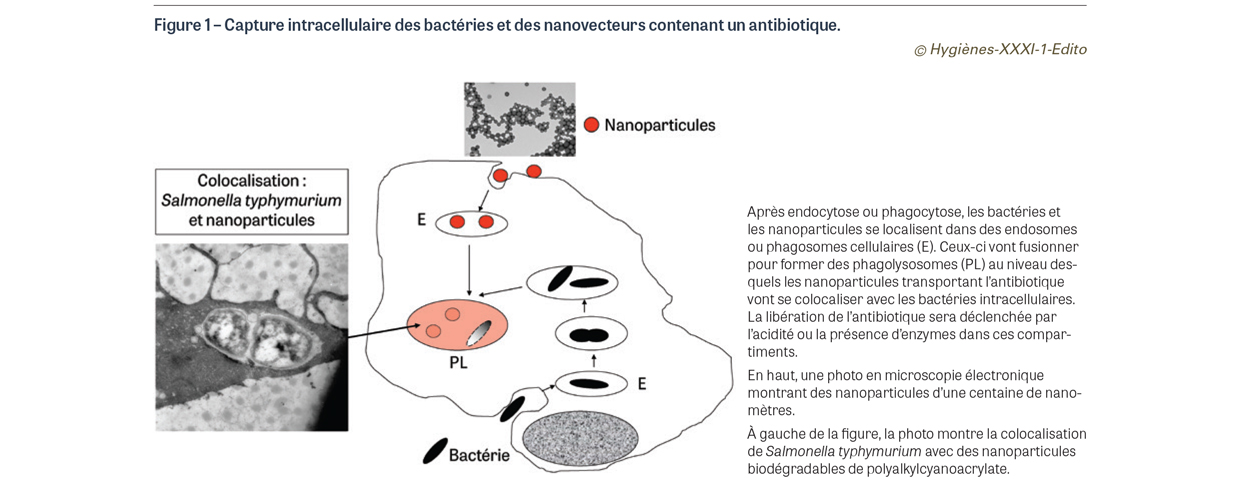
La capacité qu’ont les nanovecteurs de délivrer leur contenu en antibiotique au niveau des cellules et tissus infectés est illustrée par certains travaux réalisés dans notre laboratoire.
Nous avons, en effet, observé que l’encapsulation de l’ampicilline dans des nanoparticules de polyhexylcyanoacrylate réduisait le nombre de bactéries au niveau des tissus réservoirs et multipliait par 120 l’efficacité de l’antibiotique dans un modèle de salmonellose expérimentale chez la souris. Alors que dans le groupe des animaux non traités, 100% de mortalité est observée 10 jours après l’infection, une survie de 100% est obtenue après administration d’une dose unique d’ampicilline (0,8 mg) sous forme de nanoparticules [5]. Au niveau cellulaire, l’ampicilline nanoparticulaire est, en effet, délivrée au sein des phagosomes infectés, tandis que la distribution hépatosplénique du nanomédicament, permet d’atteindre les principaux foyers tissulaires de l’infection.
Comme déjà mentionné plus haut, l’idée a ensuite émergé de déclencher la libération de l’antibiotique exclusivement dans les compartiments intracellulaires cibles de l’infection caractérisés par un pH acide. Pour cela, nous avons construit un nanovecteur sensible à cet environnement particulier en introduisant une liaison chimique sensible au pH entre le squalène utilisé comme transporteur et la pénicilline G. Le squalène est un lipide naturel biocompatible qui adopte en milieu aqueux une conformation moléculaire compacte, ce qui explique que les bioconjugués de squalène-pénicilline G s’auto-organisent spontanément, dans l’eau, sous forme de nanoparticules d’une centaine de nanomètres. À titre de témoin de comparaison, nous avons également construit des nanoparticules de squalène-pénicilline G avec un lien chimique insensible au pH. Les deux types de nanoparticules, sensibles et insensibles au pH, ont ensuite été comparés pour leur activité antimicrobienne contre S. aureus intracellulaire. Bien que les deux nanomédicaments aient une taille rigoureusement similaire, des propriétés physico-chimiques identiques et qu’elles soient captées de la même manière par les macrophages infectés, la nanoformulation sensible au pH s’est montrée de loin la plus efficace, induisant une destruction rapide et significative de S. aureus intracellulaire [6].
Si plusieurs formulations d’amphothéricine B sous forme de liposomes (Ambisome® et Abelcet®) existent sur le marché pour le traitement des infections fongiques intracellulaires, il n’existe pas encore de nanomédicaments antibactériens. De tels développements mériteraient d’être encouragés.
Références :
1- Pinto-Alphandary H, Andremont A, Couvreur P. Targeted delivery of antibiotics using liposomes and nanoparticles: research and applications. Int J Antimicrob Agents 2000;13:155-168.
2- Abed N, Couvreur P. Nanocarriers for antibiotics: a promising solution to treat intracellular bacterial infections. Int J Antimicrob Agents 2014;43:485-496.
3- Hillaireau H, Couvreur P. Nanocarriers’ entry into the cell: relevance to drug delivery. Cell Mol Life Sci 2009;66:2873-2896.
4- Abed N, Saïd-Hassane F, Zouhiri F, et al. Efficient system for intracellular delivery of beta-lactam antibiotics to overcome bacterial resistance. Sci Rep 2015;5:13500.
5- Fattal E, Youssef M, Couvreur P, Andremont A. Treatment of experimental salmonellosis in mice with ampicillin-bound nanoparticles. Antimicrob Agents Chemother 1989;33:1540-1543.
6- Semiramoth N, Di Meo C, Zouhiri F, et al. Self-assembled squalenoylated penicillin bioconjugates: an original approach for the treatment of intracellular infections. ACS Nano 2012;6:3820-3831.