Introduction
Candida auris est une levure émergente, décrite pour la première fois en 2009 [1] et qui s’est diffusée récemment dans le monde entier. L’origine et l’émergence sont inconnues à ce jour, mais le rôle des changements climatiques a été évoqué [2]. Cette levure est responsable d’infections nosocomiales et d’épidémies en milieu hospitalier. Les premières épidémies ont été signalées en 2016 dans les hôpitaux de New York, Londres et Valence (Espagne). Depuis, C. auris a été détectée dans plusieurs pays sur les cinq continents [3]. Aux États-Unis, 18 817 cas ont été identifiés par les Centers for Disease Control and Prevention (CDC) entre 2013 et 2022 [4]. En Europe, le European Centre for Disease Prevention and Control (ECDC) a recensé 1 812 cas entre 2013 et 2021 ; la France a dénombré 15 cas durant cette même période [5]. La diffusion de C. auris se fait par transmission croisée via les mains du personnel soignant ou à partir de l’environnement. Le matériel partagé a aussi été décrit comme source de transmission [6]. En 2022, un patient a été découvert porteur de C. auris dans notre établissement et 37 cas secondaires ont été identifiés dans plusieurs services. L’objectif de ce travail est de partager l’expérience acquise lors de la gestion de cette épidémie.
Matériels et méthodes
Description de l’établissement
L’établissement est un hôpital universitaire parisien de type médecine, chirurgie, obstétrique de 450 lits appartenant à l’Assistance publique-Hôpitaux de Paris (AP-HP). Il accueille les spécialités suivantes : néphrologie, médecine interne, maladies infectieuses et tropicales (MIT), gériatrie, réanimation (deux sous-unités de dix lits), soins intensifs et soins continus, pneumologie, oncologie, dermatologie, hépato-gastro-entérologie, chirurgie (cervico-faciale, plastique, thoracique et vasculaire, urologique, gynécologique), maternité et dialyse. L’unité de prévention du risque infectieux (Upri) est composée d’un équivalent temps plein (ETP) praticien, d’un ETP cadre hygiéniste, d’un ETP infirmier hygiéniste, d’un ETP technicien biohygiéniste et d’une secrétaire.
Définitions
Nous avons défini comme cas tout patient colonisé ou infecté par C. auris, identifié par culture ou par PCR1 quantitative (qPCR), quel que soit le site de prélèvement (clinique ou de dépistage). Un contact est un patient pris en charge par la même équipe soignante qu’un cas.
Microbiologie
Le dépistage de C. auris a été réalisé à partir d’écouvillons nasaux et cutanés (pli axillaire et inguinal) eSwab® (Copan Group, Brescia, Italie). Les écouvillons ont été ensemencés sur gélose sélective CHROMagar Candida Plus (CHROMagar, Paris, France) et incubés 48 heures à 37 °C [7]. Les colonies suspectes ont été identifiées par spectrométrie de masse (MALDI-TOF2) (Bruker, Wissembourg, France). En parallèle, un test par qPCR a été systématiquement réalisé à partir du liquide de l’écouvillon Eswab® selon la technique décrite par Leach et al. [8]. Il s’agit d’une PCR en temps réel ciblant l’ADN3 ribosomique (région ITS24). Le résultat est rendu en valeur de CT (cycle threshold5), c’est-à-dire le nombre de cycles à partir duquel une fluorescence significative est détectée par le thermocycleur. Une valeur peut être considérée comme élevée à partir d’un CT≥35, ce qui correspond à une charge fongique faible. Des prélèvements d’environnement (surfaces et matériels) ont été réalisés avec des écouvillons Eswab® préimprégnés de leur liquide de conservation. Entre 5 et 10 points par chambre ont fait l’objet d’un prélèvement, ces points étant variables selon les chambres. Les écouvillons de l’environnement ont été analysés selon les mêmes techniques (culture et qPCR) que celles utilisées pour les écouvillons de patients.
Mesures de contrôle de la diffusion
En mars 2022, l’AP-HP a rédigé une note sur la conduite à tenir lors de la découverte d’un cas de colonisation ou d’infection à C. auris, reposant sur les recommandations du Haut Conseil de la santé publique (HCSP) [9] :
- mise en place des précautions complémentaires contact (PCC) renforcées C. auris pour les patients porteurs ;
- sensibilisation à la désinfection rigoureuse des mains par friction hydro-alcoolique ;
- renforcement du bionettoyage par un produit actif sur C. auris (Oxyfloor®, Laboratoires Anios, Lezennes, France) compte tenu de la persistance de cette levure dans l’environnement [10] et de sa résistance décrite aux ammoniums quaternaires [11] ;
- dépistage des contacts toutes les semaines par qPCR et culture à partir d’écouvillons nasaux et cutanés ;
- signalement externe.
Devant l’apparition de cas secondaires, les mesures suivantes ont été prises (Encadré 1) :
- création de trois secteurs : « porteurs » (colonisés/infectés), « contacts » et « indemnes », avec des équipes soignantes dédiées ;
- arrêt des transferts et des admissions, retour à domicile possible ;
- identification des patients contacts des quatre semaines précédant la découverte de l’épidémie avec mise en place des PCC renforcées C. auris, alerte informatique et information de l’Upri du site receveur si le patient contact est déjà transféré ;
- dépistage des patients contacts par culture et qPCR à partir d’écouvillons nasaux et cutanés (trois séries de dépistage programmées à une semaine d’intervalle) ;
- bionettoyage de l’environnement et du matériel partagé avec un produit actif sur C. auris (Oxyfloor®), deux fois par jour dans tout le service ;
- double bionettoyage suivi d’un bionettoyage par la vapeur après la sortie des patients porteurs ;
- prélèvements d’environnement à la sortie des patients porteurs (de cinq à dix points par chambre) et chambre fermée dans l’attente de résultats conformes par qPCR et culture ;
- formation des équipes par l’Upri aux précautions standard, complémentaires et au bionettoyage ;
- mise en place d’une cellule de crise hebdomadaire puis bihebdomadaire comprenant les services cliniques concernés, l’Upri, le laboratoire de mycologie, la direction, la direction des soins, le service logistique, la pharmacie et l’Upri du siège de l’AP-HP ;
- rédaction d’une note d’information pour les patients porteurs et contacts ;
- suivi de l’épidémie par tableau synoptique.
Encadré 1 – Conduite à tenir en cas d’épidémie à Candida auris, document Assistance publique-Hôpitaux de Paris, mars 2022
Situation 4 : épidémie (au moins un cas secondaire)
- Arrêter les transferts dans l’attente de la maîtrise de la situation.
- Regrouper les cas, contacts et patients indemnes en trois secteurs distincts, idéalement avec des équipes soignantes dédiées. Si marche en avant, éviter que les personnels prennent en charge des patients indemnes et des porteurs.
- Dépister les contacts toutes les semaines tant que l’épidémie n’est pas contrôlée et qu’un porteur est présent.
- Renforcer l’accompagnement par l’EOH des équipes du service, de jour et de nuit, y compris les fins de semaine, pour assurer un haut niveau de respect des précautions standard, notamment l’hygiène des mains.
- Renforcer le bionettoyage de l’environnement et du matériel partagé (pèse-personnes, échographe, zone de préparation des soins, zones fréquemment touchées comme les claviers d’ordinateur…).
- Prélèvements d’environnement selon avis de l’EOH.
- Mettre en place un dispositif de repérage informatique et d’alerte lors des réhospitalisations des cas et des contacts.
- En cas de réhospitalisation, placer les patients contacts en PCC et les dépister.
- Épidémie considérée comme contrôlée après trois dépistages négatifs des contacts hors exposition.
Lorsque l’épidémie est contrôlée, après la sortie des porteurs, il est possible d’arrêter les dépistages et de retirer des listes de suivi les patients contact à risque élevé dont au moins trois dépistages successifs réalisés à une semaine d’intervalle et hors exposition sont négatifs. Après un an sans nouveau cas, retirer les contacts non dépistés des listes de suivi.
EOH : équipe opérationnelle d’hygiène ; PCC : précautions complémentaires contact.
Résultats
Prise en charge du cas index
Le cas index est un patient koweïtien de 19 ans, pris initialement en charge au Koweït après un accident de la voie publique puis transféré en chirurgie puis en réanimation dans notre hôpital en juillet 2022. À son admission, il présente de multiples fractures et une perte de substance lombaire. Il est identifié porteur de bactéries multirésistantes (BMR) et hautement résistantes émergentes (BHRe) au niveau de plusieurs sites (Staphylococcus aureus résistant à la méticilline, Pseudomonas aeruginosa résistant aux carbapénèmes, Acinetobacter baumannii résistant à l’imipénème, entérobactérie productrice de carbapénèmase). Aucun dépistage à la recherche de C. auris n’est réalisé à son admission. Il est pris en charge en chambre individuelle avec des PCC renforcées. Sa charge en soins est importante ; il bénéficie notamment de multiples interventions chirurgicales pour soins de plaie et d’une thérapie par pression négative. Fin septembre 2022, un prélèvement de plaie, puis secondairement une hémoculture en décembre, dont le point de départ est osseux, sont positifs en culture à C. auris. Cette souche est résistante au fluconazole, mais sensible aux échinocandines et à l’amphotéricine B. Le patient est traité par caspofungine. Il retourne au Koweït fin janvier 2023. Dès l’identification de C. auris, les PCC renforcées C. auris sont mises en place. Les équipes de réanimation sont accompagnées par l’Upri. Le patient est pris en charge selon le principe de la marche en avant (devant l’impossibilité de mettre à disposition du personnel dédié). Les dépistages du cas index et des patients contacts de réanimation sont réalisés toutes les semaines par qPCR et culture. Un signalement externe aux autorités sanitaires est effectué. Des prélèvements d’environnement sont réalisés en réanimation en novembre 2022 dans la chambre du patient porteur et dans une chambre témoin, par qPCR et culture. Dans la chambre du patient porteur, quatre prélèvements de surface sur dix sont positifs par qPCR et négatifs par culture (poignée de porte, chariot de soin, barrière de lit et poignée du lave-bassin). Dans la chambre témoin, les dix prélèvements sont négatifs par qPCR et culture.
Description et gestion de l’épidémie
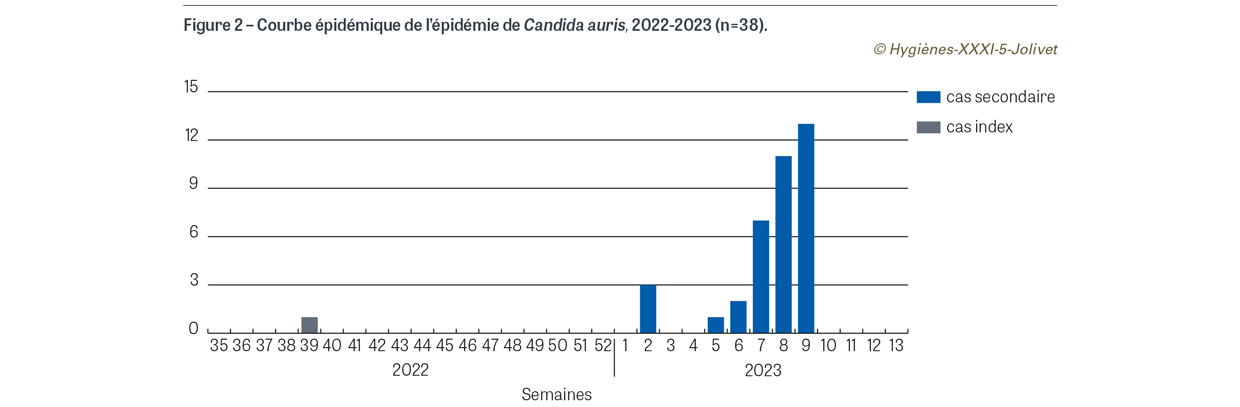
Lors d’un dépistage hebdomadaire en janvier 2023 en réanimation, soit après cinq mois d’hospitalisation du cas index et trois mois après la découverte du C. auris, trois patients contacts sont identifiés positifs à C. auris par qPCR (valeur de CT élevée correspondant à une très faible charge fongique), avec cultures négatives. Au moment du signalement par le laboratoire, un cas est décédé, un est transféré dans le service MIT et un est toujours hospitalisé en réanimation (Figure 1). Les mesures de contrôle de l’épidémie sont mises en place. Début février, lors de la troisième série de dépistage des patients contacts, un patient dialysé contact du patient du service MIT est identifié porteur par qPCR. Ce patient porteur est alors pris en charge dans un service de dialyse dédié. Par la suite, deux patients contacts au MIT sont identifiés porteurs par qPCR lors des deuxième et quatrième dépistages. Dans les trois semaines suivantes, lors du dépistage des patients contacts, 31 patients sont identifiés porteurs par qPCR (cultures négatives) dans les services de dialyse (n=13), néphrologie (hospitalisation et soins continus) (n=16), médecine interne (n=1), unité de soins continus (USC) de chirurgie (n=1) : sept cas en semaine 7, onze cas en semaine 8 et treize cas en semaine 9 (Figures 1 et 2). Neuf patients sont positifs dans les trois premiers jours d’hospitalisation. Sept patients sont identifiés positifs lors du quatrième dépistage. Les mesures sont mises en place au fur et à mesure dans les services concernés avec création de secteurs porteurs, contacts et indemnes. Les patients contacts et porteurs réadmis sont réhospitalisés dans un secteur dédié. L’Upri vérifie quotidiennement les mouvements et réhospitalisations des patients contacts et porteurs afin de s’assurer du respect de la sectorisation. Un circuit est organisé au bloc opératoire avec une salle dédiée pour la prise en charge des cas et des contacts. Une sensibilisation du personnel est faite au service des urgences afin de repérer systématiquement les patients contacts réhospitalisés (alerte dans le dossier patient informatisé). Une communication auprès des cadres et des chefs de service du groupe hospitalier est réalisée pour les informer de la situation épidémique. L’Upri du siège de l’AP-HP vient renforcer l’Upri de l’établissement.
Au total, 37 cas secondaires sont identifiés par qPCR parmi les patients contacts dans six services. Les valeurs de CT des tests qPCR des dépistages des cas secondaires sont comprises entre 34 et 44 (charge fongique faible) et toutes les cultures sont négatives. Pour le cas index, les valeurs de CT des tests qPCR sont comprises entre 22 et 40, et les cultures fréquemment positives (12/19 dépistages, 63%). Parmi les cas secondaires, quatre patients sur 33 (ayant eu au moins deux tests qPCR) ont eu deux dépistages positifs. Trente-trois patients ont eu entre un et sept tests qPCR négatifs après le dernier test qPCR positif. Quatre patients n’ont pas eu de dépistages après leurs dépistages positifs. Aucun des cas secondaires n’a développé d’infection. Devant ces résultats discordants avec qPCR positive et culture négative, il est décidé d’étendre les prélèvements au niveau du nez, de la bouche, de la peau (plis axillaire et inguinal, paume des mains, pieds) et de la région périanale, et de prolonger les cultures pendant au moins sept jours. Une consultation est proposée aux patients porteurs non hospitalisés afin de les dépister de manière extensive. Tous les tests qPCR et les cultures de contrôle étant négatifs, il est décidé de considérer le patient comme décolonisé après au moins quatre prélèvements négatifs par qPCR et culture en au moins quatre semaines, dont un dépistage extensif (décision collégiale de Santé publique France, du centre d’appui pour la prévention des infections associées aux soins [CPias] Île-de-France et de l’AP-HP). Ces patients sont ensuite pris en charge selon les précautions standard. Cette nouvelle définition a permis de clôturer l’alerte à 25 patients et de fermer les unités « porteurs ».
Environ 350 patients contacts sont identifiés durant l’épidémie. Jusqu’à trois dépistages négatifs hebdomadaires hors exposition sont requis pour pouvoir clôturer les alertes. Un total de 2 498 dépistages est réalisé par le laboratoire de mycologie entre janvier et juin 2023. Aucun nouveau cas n’est identifié depuis février 2023.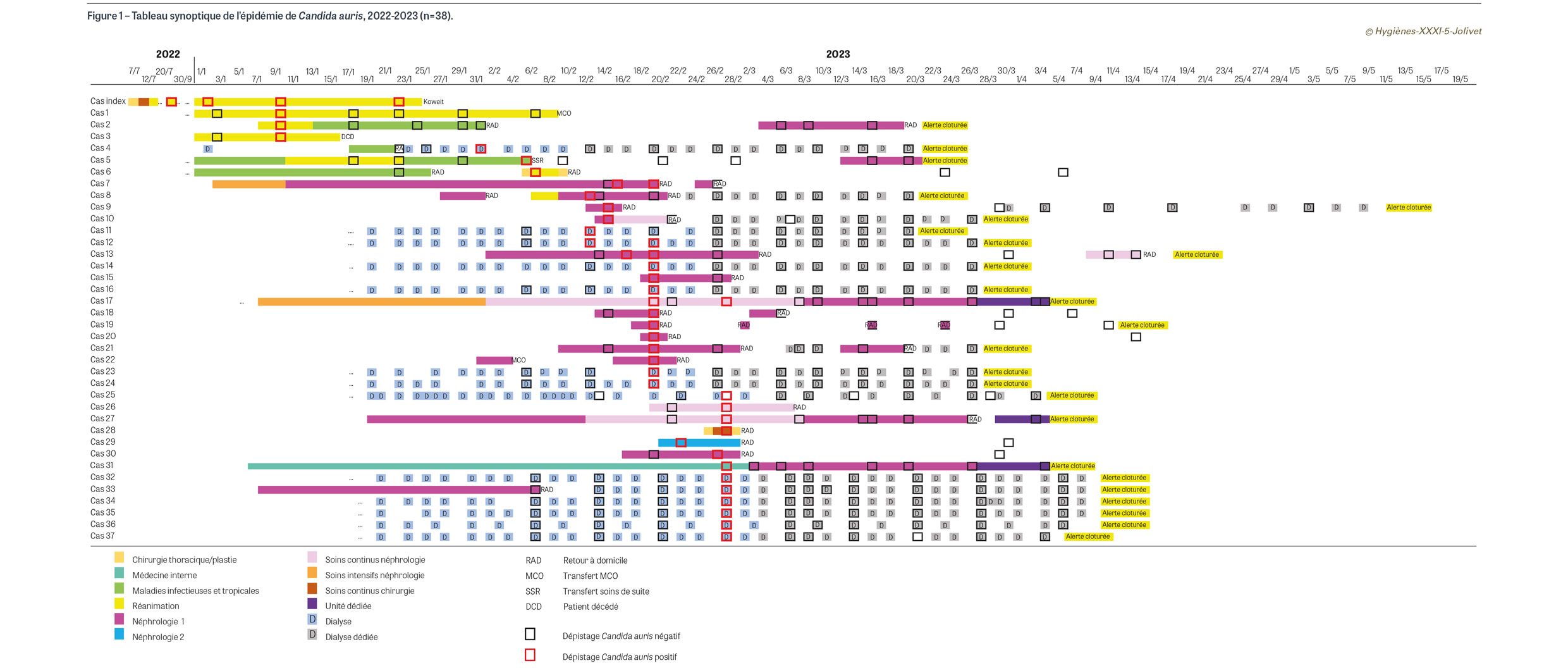
Prélèvements d’environnement
Durant l’épidémie, 429 prélèvements d’environnement sont réalisés : dans les chambres à la sortie de patients porteurs après bionettoyage, dans des chambres témoin en réanimation, dans les unités « porteurs » après la sortie du dernier patient, dans trois salles où a été pris en charge le cas index (scanner, bloc opératoire et salle de cathéter), ainsi qu’à partir de matériels partagés. Les chambres prélevées ont été choisies par l’Upri sur des critères de durée d’hospitalisation du patient et d’existence de cas secondaires dans le service. Quarante-deux prélèvements sont réalisés dans la chambre du cas index, 28 (66,7%) sont positifs par qPCR. De nombreux bionettoyages sont réalisés (Oxyfloor® et vapeur), et du matériel est remplacé (barrière de lit, thermomètre) devant la persistance de résultats positifs par technique de qPCR. En réanimation, sur 123 prélèvements hors chambre du cas index, douze (19,8%) sont positifs par qPCR, dont du matériel partagé (laryngoscope et appareil d’échographie) ; un point est également testé positif dans une chambre témoin. Hors réanimation, sur 264 prélèvements réalisés, quatre (1,5%) sont positifs par qPCR, dans la chambre d’un cas de l’unité de soins continus de néphrologie. Les prélèvements de contrôle après plusieurs séquences de bionettoyage sont testés négatifs par qPCR. Aucun prélèvement environnemental testé positif par qPCR ne donne lieu à une culture de C. auris.
Discussion
Cette épidémie à C. auris est la première d’une telle ampleur en France et est riche d’enseignements. Tout d’abord, le premier cas a été identifié tardivement, malgré les recommandations du HCSP en 2019 [9] et de l’AP-HP en mars 2022 incitant à dépister les patients hospitalisés dans les douze mois précédents dans une zone d’endémie à C. auris, comme le Koweït [12,13]. Cependant, le retard à l’identification du cas index n’a pas été à l’origine de l’épidémie car les cas secondaires sont survenus cinq mois après son admission. La mise en place très précoce des PCC renforcées du fait du portage de BMR et BHRe a probablement permis de limiter la diffusion à la phase initiale. Depuis, une communication a été réalisée sur l’importance de l’identification précoce des patients à risque de portage de C. auris. L’AP-HP et le Centre national de référence mycoses invasives et antifongiques (CNRMA) ont élargi les recommandations de dépistage à tout patient hospitalisé à l’étranger dans l’année précédente sans distinction de pays à risque [14]. L’évolution de l’épidémie avec arrêt brutal après une flambée de cas, comme le montre la courbe épidémique (Figure 2), n’est pas habituelle. Aucun des cas secondaires n’a développé d’infection alors que, dans la littérature, les infections à C. auris sont fréquentes chez des patients colonisés [15]. De même le fait qu’aucun des cas secondaires n’ait eu de culture positive est inhabituel [16,17] et pose la question de l’interprétation des résultats de prélèvements avec qPCR positive et culture négative. De plus, la majorité des patients n’a eu qu’un seul test positif par qPCR, les suivants étant négatifs. Une discussion collégiale avec les équipes du CNRMA, du CPias et de Santé publique France a permis d’évoquer différentes hypothèses. La possibilité de faux positifs en qPCR a été envisagée mais écartée devant la conformité des témoins négatifs lors des tests qPCR et des nombreux prélèvements négatifs chez différents patients témoins, puis la négativité des tests qPCR chez les patients précédemment colonisés. La possibilité d’un défaut de sensibilité de la culture a aussi été envisagée. Il est à noter qu’au début de l’épidémie les cultures n’étaient conservées que 48 heures. Des études précédentes ont montré que C. auris pouvait avoir une croissance ralentie, ce qui justifie la conservation des cultures cinq à sept jours [18]. Pour améliorer la sensibilité de la culture chez les patients présentant un test qPCR positif, le nombre de sites prélevés a été élargi (nez, bouche, régions périanale, axillaire et inguinale, paume des mains, pieds), et les cultures conservées pendant au moins sept jours. Toutes sont restées négatives. Finalement les faibles niveaux de positivité des tests qPCR (valeurs de CT élevées) plaident pour une faible charge fongique transitoire chez les cas secondaires avec décolonisation rapide, ce qui pourrait expliquer que les cultures soient restées négatives. La place des tests de qPCR dans la gestion des épisodes à C. auris reste à définir. Taori et al. ont décrit une épidémie de C. auris avec utilisation de tests PCR pour le suivi des contacts. Vingt-deux patients ont été identifiés, tous colonisés et deux uniquement par PCR [17]. Son avantage est de permettre une identification rapide des cas ; en revanche, si le test est positif, il doit être confirmé par une culture. À la suite de cette épidémie, une proposition d’interprétation d’un résultat PCR positif et une définition de cas selon les résultats des qPCR et des cultures ont été diffusées par l’AP-HP et le CNRMA (Figure 3) [14]. Si l’hypothèse d’une faible charge fongique est retenue, il faut néanmoins noter qu’elle a été suffisante pour permettre une transmission et entraîner des cas secondaires. La diffusion entre services s’est probablement faite par le transfert de patients porteurs identifiés tardivement entre la réanimation, les services de médecine, de chirurgie et de dialyse. Neuf patients se sont avérés positifs très rapidement après leur admission dans l’établissement (≤3 jours), montrant la rapidité de dissémination de cette levure comme précédemment décrit [19]. À l’inverse, sept patients se sont révélés positifs au quatrième dépistage, en particulier des patients en dialyse. Cependant, les dépistages n’avaient pas été réalisés hors exposition.
À l’inverse de certaines épidémies décrites dans la littérature [3], celle-ci a été maîtrisée rapidement grâce aux mesures de contrôle appliquées rigoureusement, en particulier la sectorisation et la création d’unités dédiées, l’arrêt des transferts, le renforcement de l’hygiène des mains et le bionettoyage avec un produit actif sur C. auris, et peut-être également grâce au dépistage extensif par qPCR. Des cellules de crise bihebdomadaires permettaient la coordination entre les différents intervenants et les directions.
Des prélèvements d’environnement ont été trouvés positifs par qPCR, plus fréquemment dans la chambre du cas index (66,7%) que dans les chambres des cas secondaires (4,1%), alors que le bionettoyage était réalisé avec le même produit détergent-désinfectant actif sur C. auris. De plus, l’environnement était plus souvent contaminé en réanimation que dans les autres services ; en effet, seule une chambre en soins intensifs de néphrologie a été testée positive hors réanimation. Cette différence peut s’expliquer par une plus forte charge fongique chez le cas index que chez les cas secondaires. Dans notre étude, de nombreux prélèvements étaient positifs par qPCR, dont du matériel partagé, et la contamination a persisté malgré plusieurs séquences de bionettoyage amenant à éliminer certains matériels. La persistance de la contamination de matériels pourrait jouer le rôle de réservoir de transmission, comme précédemment décrit [20]. Là encore, l’interprétation des résultats de qPCR en l’absence de culture positive n’est pas univoque, celle-ci pouvant refléter la présence de séquences non viables d’ADN de C. auris.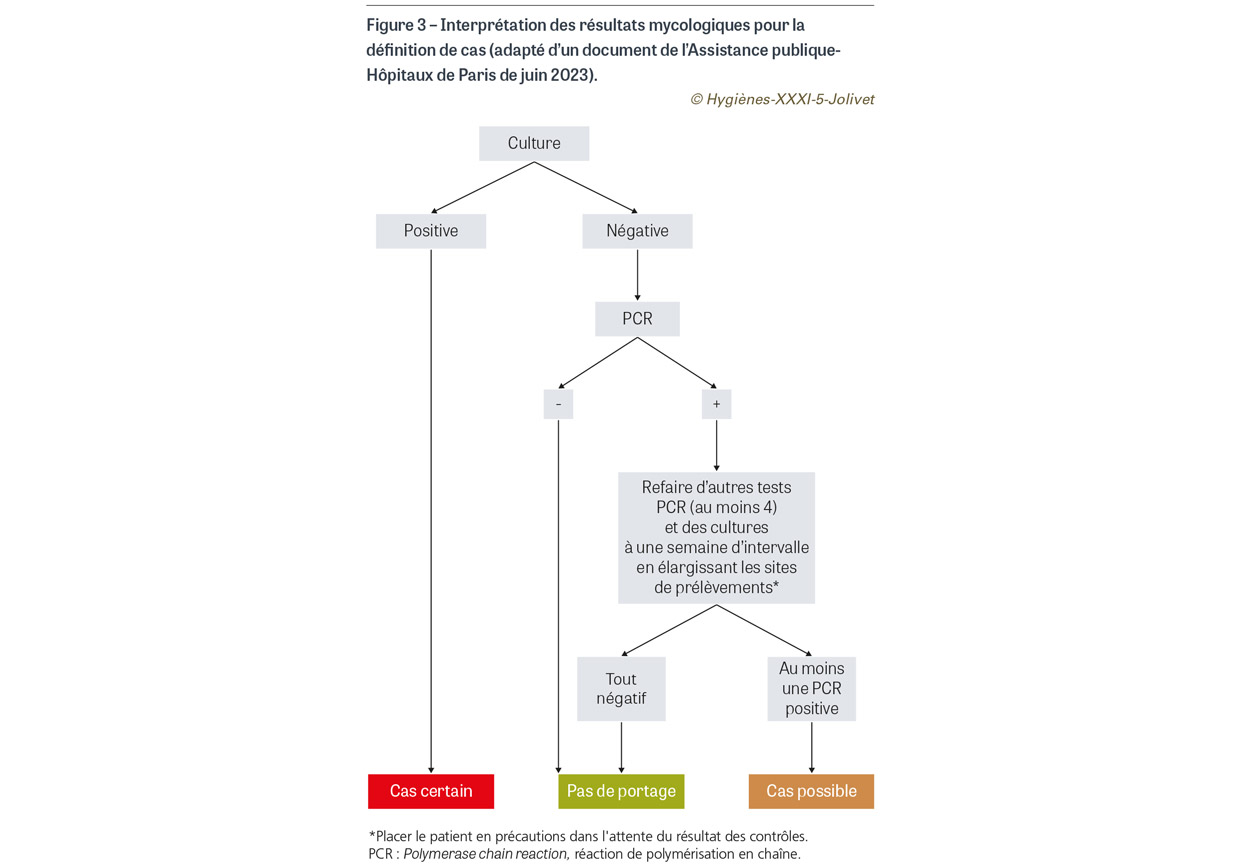
Conclusion
C. auris est une levure émergente à fort potentiel épidémique. Les mesures de contrôle de la diffusion sont d’autant plus efficaces qu’elles sont appliquées tôt, ce qui plaide pour une identification rapide des cas. Elle est identifiée dans la majorité des cas chez des patients ayant été hospitalisés à l’étranger ; il est donc très important que les cliniciens soient sensibilisés au dépistage des patients à risque et que les laboratoires de microbiologie aient les moyens d’identifier rapidement les souches suspectes. Le contrôle de l’épidémie requiert une approche pluridisciplinaire, incluant une communication importante, un dépistage précoce, des mesures de précautions complémentaires et de cohorting, un suivi des contacts, un bionettoyage adapté et un renforcement de l’hygiène des mains.
Notes :
1- Polymerase chain reaction, réaction de polymérisation en chaîne en temps réel.
2- Matrix-assisted laser desorption/ionization - time-of-flight mass spectometry, spectrométrie de masse à temps de vol pour la désorption-ionisation laser assistée par matrice.
3- Acide désoxyribonucléique.
4- Internal transcribed spacer 2.
5- Threshold : seuil.