Introduction
Ces dernières décennies ont été marquées par l’émergence de bactéries multirésistantes (BMR), avec comme principales représentantes les entérobactéries productrices de bêtalactamases à spectre étendu (E-BLSE) et les Staphylococcus aureus résistant à la méticilline (Sarm). Cette émergence est la conséquence d’un mésusage des antibiotiques et d’une large diffusion au sein des établissements de santé et, plus récemment, en milieu communautaire [1,2,3]. L’implication des BMR dans les infections peut entraîner un retard à l’instauration d’une antibiothérapie adaptée, conduisant à une perte de chance pour le patient [4]. Par conséquent, une maîtrise de la diffusion des BMR est nécessaire pour améliorer la prise en charge globale des patients. En établissement de santé, les précautions standard (PS) sont mises en œuvre pour diminuer le risque d’acquisition d’infection [5]. Lors d’un portage de BMR, la mise en place de précautions complémentaires contact (PCC) est recommandée [6]. Depuis une dizaine d’années, des auteurs remettent en question l’impact des PCC sur la transmission croisée de BMR [7,8] et recommandent de recentrer les pratiques autour des PS. Diverses études semblent montrer une absence d’impact de l’abandon des PCC sur le taux de transmission croisée de BMR [9,10,11,12,13]. De plus, la mise en place de PCC a des conséquences sur l’organisation et la charge de travail de l’équipe soignante (médicale et paramédicale) et pourrait avoir des effets négatifs sur le patient [14]. Dans ce contexte, une remise en question de l’intérêt de la mise en place des PCC pour la prise en charge des patients porteurs d’Escherichia coli producteur de bêtalactamases à spectre étendu (ECBLSE) a été effectuée au centre hospitalier universitaire (CHU) de Rennes. Nous avons engagé une réflexion sur ce sujet en ciblant les ECBLSE, bactéries ayant un réservoir communautaire [1,2] et un pouvoir épidémiogène moindre [15,16,17,18,19]. Dans un premier temps, une étude interventionnelle comparative a été effectuée dans le service de réanimation chirurgicale de 2011 à 2013 (A. Morin et al., non publié), qui a permis d’estimer la transmission croisée dans ce service pendant deux périodes distinctes : une première période contrôle avec la mise en place de PCC, et une seconde période d’intervention avec l’application des PS seules si le patient était porteur d’ECBLSE. Entre les deux périodes, les taux d’acquisition d’ECBLSE retrouvés étaient similaires et aucun évènement de transmission croisée (ETC) n’a pu être confirmé par comparaison des profils de restriction de l’acide désoxyribonucléique (ADN) des isolats. Le nombre de patients déjà porteurs d’ECBLSE à l’admission était plus élevé sur les deux périodes que les patients chez qui le dépistage devenait positif en cours d’hospitalisation. Ces résultats suggèrent donc un apport exogène majoritaire des ECBLSE ainsi qu’une absence de transmission croisée pendant les deux périodes (contrôle et intervention). Au vu de ces résultats, l’abandon des PCC autour des patients porteurs d’ECBLSE a été étendu à tous les services du CHU de Rennes en janvier 2015. Nous rapportons ici une évaluation de cette évolution des pratiques après plus de 3 ans d’application1.
Population et méthode
Critères d’inclusion et définitions
Cette étude rétrospective a été réalisée au CHU de Rennes de janvier 2015 à octobre 2018. Tous les prélèvements, de dépistage et à visée diagnostique, positifs à ECBLSE ont été recueillis à l’aide des logiciels TD-Synergy® (LIG-System) et SIRscan® (i2a). Les données collectées pour chaque isolat comprenaient les antibiogrammes par méthode de diffusion, y compris les diamètres d’inhibition. Un profil de sensibilité aux antibiotiques entre deux isolats était défini comme similaire si les sensibilités aux antibiotiques présentaient au maximum une seule différence mineure sur l’antibiogramme (S→I, I→S, I→R, R→I2) [20]. Les prélèvements provenant des services des urgences, des hôpitaux de jour, des consultations externes et de dialyse ont été exclus de l’étude.
Critères de premier niveau de suspicion d’évènement de transmission croisée
Critères « isolats »
Pour estimer l’état d’acquisition du patient porteur d’ECBLSE à l’hôpital, les isolats ont été classés en deux catégories (J0 étant la date d’admission dans l’établissement) :
- catégorie A : isolat provenant d’un prélèvement effectué entre J0 et J2. Lors du séjour, les isolats suivants ont été classés dans la même catégorie si le profil de sensibilité aux antibiotiques était similaire ;
- catégorie B : isolat provenant d’un prélèvement effectué à partir de J3, soit chez un patient non identifié comme porteur entre J0 et J2, soit chez un patient avec des isolats différents (avec profil de sensibilité aux antibiotiques différent).
Critères « patients » successifs
Ces critères ont été appliqués à la population étudiée pour évaluer la probabilité des patients d’être impliqués dans un ETC. Dans l’ordre ont été appliqués :
- un premier critère permettant de relier temporellement et spatialement différents patients : au moins deux patients hospitalisés dans la même unité fonctionnelle (UF) avec un intervalle de date de prélèvement maximal de 20 jours ;
- un deuxième critère basé sur le profil de sensibilité : isolats proches ayant un profil de sensibilité aux antibiotiques similaire ;
- un troisième critère : qui distingue les isolats répondant aux deux premiers critères et dont au moins l’un des isolats est de catégorie B.
Méthode de comparaison par distance euclidienne
Tous les isolats répondant aux critères de 1er niveau ont été soumis à une méthode d’affiliation phénotypique par distance euclidienne. Cette méthode a permis d’associer des isolats entre eux selon les diamètres d’inhibition observés sur leurs antibiogrammes [21]. La distance euclidienne était calculée entre 2 isolats j et k par la somme des différences des diamètres d’inhibition χ pour chaque antibiotique i et était exprimée en millimètres :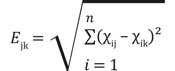
Plus la distance euclidienne était basse, plus les isolats étaient proches phénotypiquement. Les isolats ont ainsi été classés en différents groupes (seuil de distance euclidienne à 6 mm) et sous-groupes (seuil de distance euclidienne à 5 mm). Ces seuils ont été déterminés par rapport au nombre d’antibiotiques utilisés dans le calcul, soit 6 antibiotiques, et à l’incertitude de mesure des diamètres d’inhibition fixée à 2,4 mm. Les antibiotiques sélectionnés étaient l’acide nalidixique, la ciprofloxacine, la gentamicine, la ceftazidime, le céfotaxime et le cotrimoxazole.
Critères de second niveau de suspicion d’évènement de transmission croisée
L’application des critères de 1er niveau associée aux données obtenues à l’aide de la distance euclidienne a permis de former des groupes d’isolats considérés comme étant possiblement impliqués dans un ETC. Les dossiers des patients ayant de tels isolats ont été analysés. Les différents séjours dans les UF de chacun de ces patients ont été recherchés. Les informations comme la notion d’antécédent de portage d’ECBLSE, les dates des prélèvements bactériologiques (dont les dépistages négatifs) et la présence d’autres E-BLSE ont été recueillies. Cette analyse a permis d’affiner le caractère d’acquisition d’ECBLSE en cours de séjour. Les patients pouvaient être classés selon trois types :
- type O : un premier dépistage négatif puis un autre prélèvement positif à ECBLSE → acquisition probable ;
- type N : un prélèvement positif à ECBLSE lors des 48 premières heures d’hospitalisation → absence d’acquisition ;
- type I : absence de prélèvement dans les 48 premières heures d’hospitalisation → acquisition incertaine.
Pour déterminer les patients ayant une forte probabilité d’être impliqués dans un ETC, les éléments suivants ont été pris en considération :
- un chevauchement de période de séjour dans une même UF d’au moins deux patients correspondant à un même groupe obtenu par distance euclidienne ;
- dont au moins un des deux patients ayant une notion d’acquisition (type O ou I) comme défini ci-dessus.
La proportion de patients impliqués dans un ETC a été comparée selon le secteur d’activité du service. Les deux groupes comparés étaient les services de médecine, chirurgie, obstétrique (MCO) et les services de plus long séjour (soins de suite et de réadaptation [SSR], soins de longue durée [SLD] et établissement d’hébergement pour personnes âgées dépendantes [Ehpad]) par un test de Fischer au risque α=5%.
Résultats
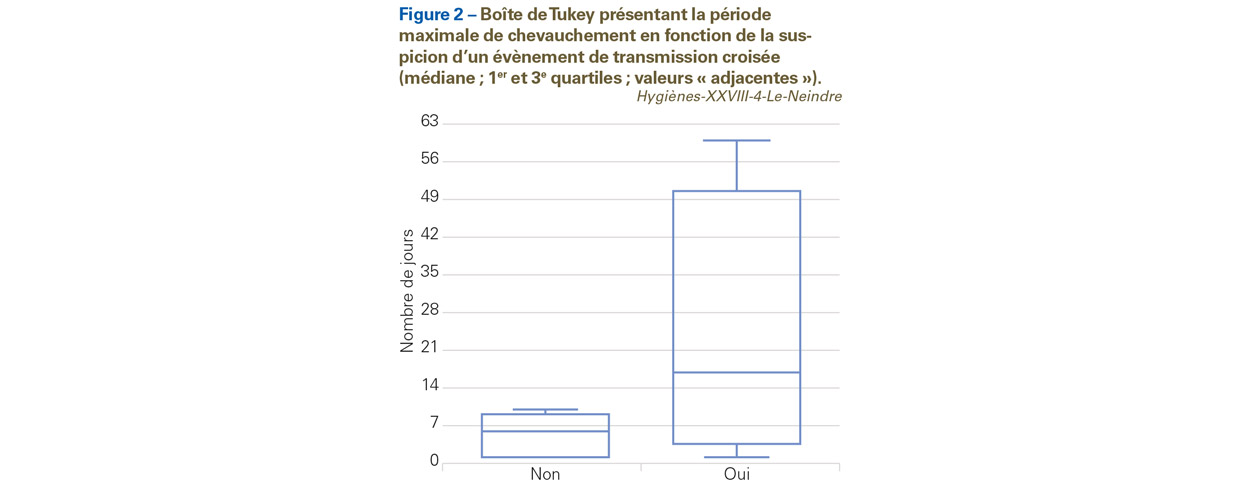
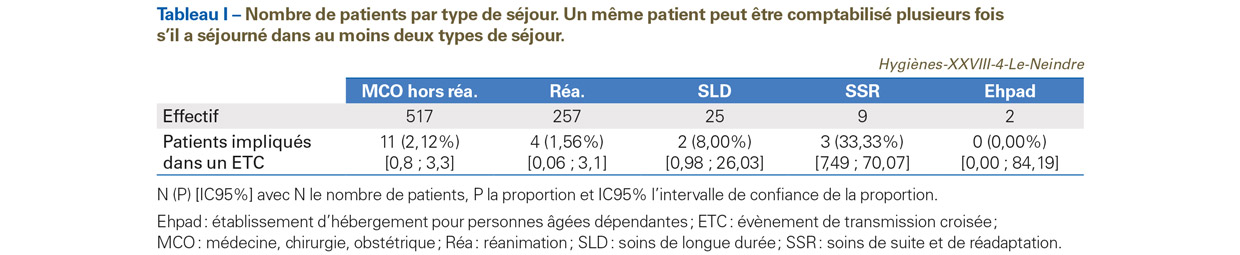
Un total de 730 patients a été inclus dans l’analyse regroupant 1 186 isolats. Les UF ayant le plus d’isolats étaient les services de réanimation et d’hématologie, ceux-ci appliquant une politique de dépistage. Le nombre d’isolats provenant de prélèvements à visée diagnostique s’élevait à 559 soit 47,1% du total des isolats. Un isolat de catégorie A a été retrouvé chez 334 patients soit 45,8%. Après application des critères de 1er niveau, 93 patients soit 12,7% ont été retenus pour analyse, correspondant à 119 isolats soit 10% des isolats totaux. Les 119 isolats ont été soumis à la méthode d’affiliation par distance euclidienne (Figure 1). Cette méthode a mis en évidence 14 groupes de A à N. Le rapprochement spatiotemporel des patients a permis d’exclure 30 patients soit 50 isolats. Au total, 63 patients ont été inclus dans la phase finale de l’analyse. Les dossiers de 8 d’entre eux n’ont pas pu être exploités. L’acquisition d’ECBLSE a été évaluée sur les 55 patients restants, soit 13 de type O, 18 de type N et 24 de type I. Un chevauchement de séjour entre au moins deux patients a été observé pour 43 d’entre eux. La durée de la période maximale de chevauchement paraissait allongée pour les patients impliqués dans un ETC (Figure 2). Après application des critères d’acquisition et de chevauchement de séjour, 9 ETC potentiels ont pu être identifiés impliquant 20 patients soit 2,7% du total de patients (Figure 1). Parmi eux, 3 (15%) avaient une acquisition probable dans l’établissement (O), pour 13 (65%) l’acquisition était indéterminée (I) et 4 (20%) avaient importé leurs isolats (N). Les UF comportant au moins un ETC probable ont été séparées selon le secteur d’activité du service (Tableau I). La proportion de patients impliqués dans un ETC était significativement associée au secteur d’activité du service (MCO/Réanimation [1,9%] comparé à SSR/SLD/Ehpad [13,9%] ; Test de Fischer p=0,0012).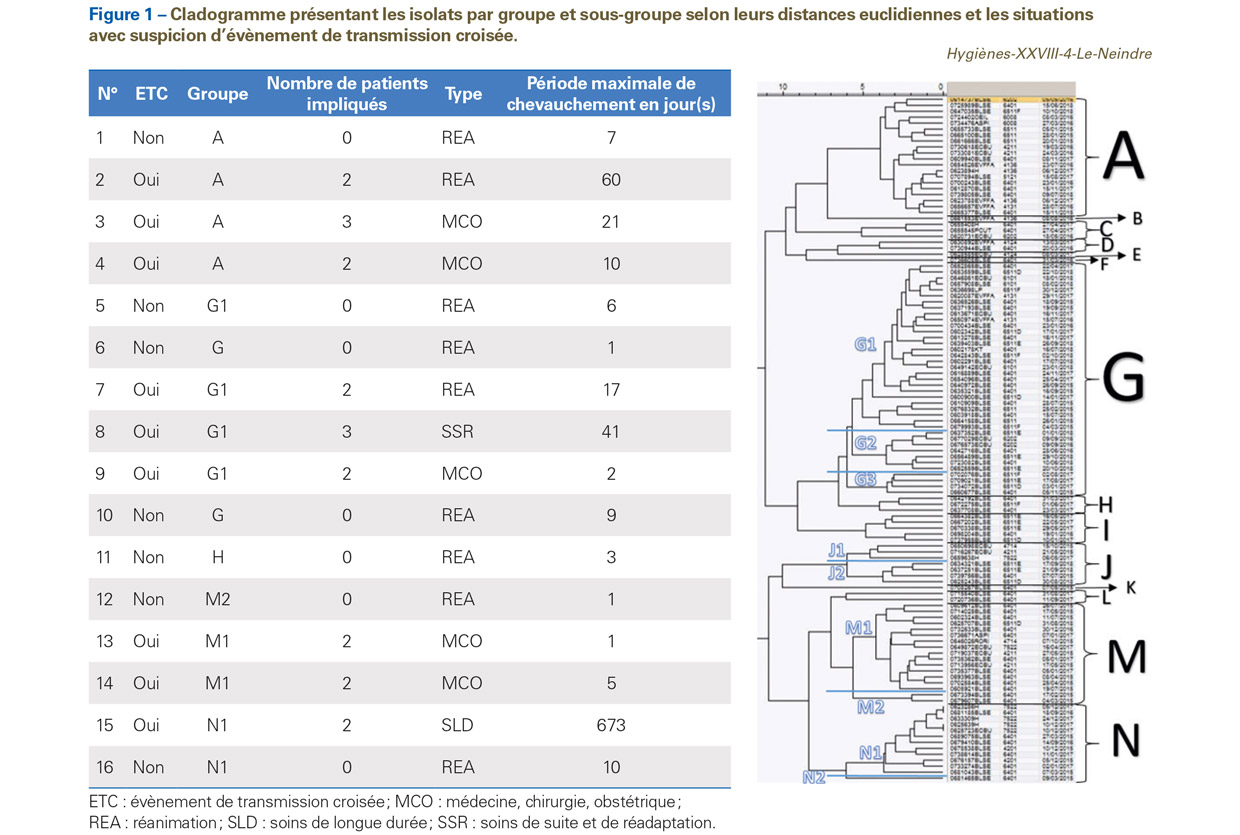
Discussion
Ces résultats ont apporté des informations sur l’épidémiologie de l’acquisition des ECBLSE. En effet, le nombre de patients avec un isolat de catégorie A a démontré qu’environ la moitié des patients avait un portage d’ECBLSE antérieur à l’hospitalisation. Sachant que l’acquisition ne peut être affirmée pour la catégorie B, le nombre de cas d’ECBLSE d’origine exogène était plus important que la seule catégorie A. Ces données sont cohérentes avec l’importance actuelle du portage d’ECBLSE retrouvé en milieu communautaire [1,2,3]. Une seconde information intéressante a été le nombre élevé d’isolats retrouvés dans les services de réanimation et d’hématologie. La politique de l’établissement comprend un dépistage systématique des E-BLSE à l’admission dans ces UF, entraînant une plus forte probabilité de découverte d’ECBLSE chez ces patients. En dehors de ces UF, la présence d’ECBLSE retrouvée dans des prélèvements à visée diagnostique était largement majoritaire. Dans la littérature, le taux de transmission croisée peut différer selon l’espèce d’entérobactérie. Hilty et al. démontraient une transmission plus élevée pour l’espèce Klebsiella pneumoniae (taux à 8,3%) que pour l’espèce Escherichia coli (taux à 4,5%) [18]. Dans notre étude, les différentes étapes d’analyse ont permis d’estimer un taux de patients probablement impliqués dans un ETC à ECBLSE à 2,7% (20 sur 730 patients porteurs). Dans la littérature, ce taux de patients impliqué varie entre 1,5% et 8,8%. Avec une prise en charge standard des patients porteurs, Harris et al. retrouvaient un taux de transmission d’ECBLSE de 3,1% (3 sur 97 patients porteurs) [22]. En l’absence de PCC, Tschudin-Sutter et al. retrouvaient dans une première étude un taux de transmission de 1,5% (2 sur 133 porteurs) [9]. Dans une deuxième étude prospective, les mêmes auteurs rapportaient un taux à 2,6% (4 sur 151 porteurs) pour un établissement de soins tertiaire et un taux à 8,8% (7 sur 80 patients porteurs) pour un établissement de SLD [12]. Dans le cas des ECBLSE, l’absence de PCC semblait avoir peu d’impact sur le risque de transmission croisée. Cependant, cette observation est à nuancer en fonction du secteur d’activité. Dans les services de SLD, peu de prélèvements cliniques sont positifs à ECBLSE et les dépistages ne sont pas réalisés à titre systématique. La présence d’un ETC est donc difficile à interpréter. Toutefois, un plus grand risque de transmission peut être observé dans les services de long séjour, liée à une période de séjour, donc d’exposition plus importante [12]. La méthodologie utilisée a permis d’estimer la transmission croisée des ECLBSE dans l’ensemble de l’établissement et conforte notre décision d’abandonner les PCC pour la prise en charge des patients porteurs. Les définitions et les critères d’inclusion établis ont permis d’identifier les patients suspects en évitant au maximum les biais d’interprétation. Cette méthodologie a facilité l’analyse portant sur un grand nombre de sujets. La méthode de comparaison phénotypique par distance euclidienne est facile à mettre en œuvre et pratique pour détecter des foyers épidémiques potentiels. Quelques limites peuvent être soulignées. Les cas suspects d’ETC n’ont pas pu être confirmés par méthode de comparaison génotypique, impossible à mettre en œuvre pour des études rétrospectives de plus d’un an. La qualité des PS en l’absence de PCC n’a pas pu être estimée et nécessiterait la réalisation d’un audit ou d’une évaluation.
Conclusion
La première étude effectuée de 2011 à 2013 dans le service de réanimation chirurgicale a démontré la possibilité de maîtriser la diffusion des Escherichia coli producteur de bêtalactamases à spectre étendu (ECBLSE) avec l’application seule des précautions standard (PS). En effet, aucun évènement de transmission croisée (ETC) en absence de précautions complémentaires contact (PCC) n’avait pu être mis en évidence. Cette étude a permis une évolution majeure dans les pratiques au CHU de Rennes avec l’abandon de la mise en place systématique des PCC dans la prise en charge d’un patient porteur d’ECBLSE. Ce changement de pratique nécessite une application stricte des PS pour éviter une augmentation significative de l’acquisition hospitalière d’ECBLSE. Un suivi épidémiologique des ECBLSE est également nécessaire pour détecter un évènement épidémique et mener une action corrective rapide. L’étude rétrospective sur plus de 3 ans présentée ici a permis une estimation de l’apport exogène des ECBLSE ainsi que la probabilité d’observer des ETC. Les données obtenues sont en accord avec celles de la littérature. Une multiplication des infections à ECBLSE communautaire est observée dans le monde et en France, à l’origine de nombreuses ECBLSE importées. Enfin, l’étude montre un taux de suspicion d’ETC inférieur à 3% du total de patients porteurs d’ECBLSE. Malheureusement, les limites de l’étude ne permettent pas une confirmation des cas suspectés. Celle-ci apporte tout de même un argument en faveur de l’arrêt de la mise en place des PCC chez les patients porteurs d’ECBLSE, améliorant ainsi la qualité de leur prise en charge globale sans augmenter le risque de dissémination hospitalière. Une suite possible à ce projet serait de mettre en place une étude prospective en temps réel pour évaluer les performances respectives du typage moléculaire et de notre méthode d’identification des ETC en routine.
Notes :
1- Ce travail a fait l’objet d’une communication orale lors de la 30e édition du congrès de la Société française d’hygiène hospitalière (2019).
2- S : sensible ; I : intermédiaire ; R : résistant.