Introduction
La prévalence des infections associées aux soins (IAS) chez les patients hospitalisés en court séjour en France est d’environ 5,2%, ce qui représente environ 750 000 personnes infectées par an [1]. Si les IAS sont majoritairement transmises par manuportage, des études ont montré que les micro-organismes de l’environnement pouvaient être impliqués dans près de 5% des IAS [2,3]. Par exemple, des cas d’infections à Serratia marcescens sont survenus à partir de solutions antiseptiques contaminées en neurochirurgie et des épidémies liées à des spores d’Aspergillus sont régulièrement rapportées suite à des travaux intra-hospitaliers [2,3]. Ces dernières années, l’hôpital Saint-Antoine (Paris) a été confronté à plusieurs épidémies qui ont pu être reliées à la contamination des toilettes. En 2016, deux patients hospitalisés à six mois d’écart dans la même chambre du service d’hématologie ont présenté une pneumopathie nosocomiale liée à L. pneumophila. Cette contamination demeurait inexplicable dans la mesure où l’environnement de ces patients était protégé par des filtres anti-légionelles sur les embouts des robinets et des douches et par un traitement de l’air. Par ailleurs les patients buvaient de l’eau embouteillée. Les sanitaires ont été suspectés et des contrôles microbiologiques réalisés après le deuxième cas ont permis de retrouver une concentration importante de L. pneumophila dans les siphons des toilettes, mais pas dans l’eau des lavabos et des douches. L’analyse par WGS (whole genome sequencing1) a montré une proximité génétique entre les isolats provenant des échantillons cliniques des patients et ceux retrouvés dans l’eau du siphon, suggérant que la transmission se faisait par aérosolisation de l’eau des toilettes [4]. Le même service d’hématologie a fait face entre janvier 2016 et juin 2018 à une épidémie majeure de colonisations et/ou d’infections à Citrobacter freundii producteur de carbapénémase de type OXA-482. Une transmission manuportée par le personnel hospitalier a d’abord été suspectée. Une unité dédiée avec du personnel spécifique a été créée pour isoler les patients porteurs de cette bactérie des patients non porteurs. Malgré cette mesure, de nouveaux cas sont survenus, suggérant la possibilité d’un réservoir environnemental. Des investigations microbiologiques ont révélé que plusieurs toilettes étaient contaminées par C. freundii producteur d’OXA-48 et une enquête épidémiologique a montré que les nouveaux patients qui avaient acquis la bactérie avaient plus souvent fréquenté les chambres dont les toilettes présentaient des résultats de prélèvements positifs [5]. L’unité de prévention du risque infectieux a également constaté que les toilettes étaient fortement entartrées et ne possédaient pas d’abattant. Après changement de toutes les toilettes, l’épidémie a été contrôlée et aucun nouveau cas de transmission n’est survenu dans les neuf mois suivants. Enfin, au cours d’une étude prospective, nous avons montré que 11,3% des surfaces prélevées dans des chambres de patients infectés par Clostridioides difficile étaient contaminées par des spores [6]. Les sites les plus fréquemment contaminés étaient le sol des toilettes (23,1%), les lunettes des toilettes (15,7%) et le lavabo (14,2%). Dans cette étude, 12% à 15% des prélèvements d’air des toilettes et des chambres étaient positifs à C. difficile. À la suite de ces trois observations, nous avons émis l’hypothèse que les toilettes pouvaient être à l’origine d’une aérosolisation de particules infectieuses et constituer une source de transmission de pathogènes.
Objectif
L’objectif de cette étude était d’évaluer expérimentalement la potentielle dissémination de certaines bactéries (C. freundii producteur de carbapénémase de type OXA-48, L. pneumophila et C. difficile) à partir des toilettes de l’hôpital.
Matériel et méthode
Souches
Nous avons utilisé les deux souches bactériennes de C. freundii et L. pneumophila responsables des épidémies précédemment citées ainsi qu’une souche non toxinogène (non pathogène) de C. difficile. Les souches ont été repiquées sur des milieux sélectifs appropriés : milieu Drigalski (bioMérieux, Marcy-l’Étoile, France) pour C. freundii (incubation en aérobiose pendant 24 heures), milieu ChromIDTM C. difficile (bioMérieux, Marcy-l’Étoile, France) pour C. difficile (incubation en anaérobiose pendant 48 heures) et milieux BCYE3 et GVPC4 (Oxoid Limited, Basingstoke, Royaume-Uni) pour L. pneumophila (incubation en aérobiose pendant 5 à 7 jours).
Plan expérimental
Pour chacune des trois bactéries, des suspensions de turbidimétrie comprise entre 2 et 4 McFarland (c’est-à-dire entre 6.108 bactéries/ml et 1,2.109 bactéries/ml) ont été préparées dans 100 ml de sérum physiologique (0,85%). La dispersion environnementale de chaque bactérie a été évaluée séparément. Chaque suspension a été versée dans le siphon des toilettes (préalablement nettoyées et vidangées à 3-4 reprises) d’une chambre située dans un service inoccupé. L’eau du siphon a été mélangée puis les bactéries quantifiées par dilution sériée. Pour évaluer la dissémination environnementale, nous avons placé 15 boîtes de Pétri autour des toilettes à des distances variables afin de potentiellement recueillir des microgouttelettes contaminées (Figure 1). Nous avons également prélevé l’air par impaction5 à l’aide d’un biocollecteur (Air Ideal® 3P®, bioMérieux, Marcy-l’Étoile, France), placé à une hauteur de 1,6 m. Après avoir ouvert les boîtes de Pétri, nous avons tiré une première fois la chasse d’eau puis déclenché le biocollecteur (prélèvement de 1 m3 pendant 10 minutes, sauf pour les légionelles, pour lesquelles 0,5 m3 était prélevé pendant 5 minutes afin d’éviter les contaminations aspergillaires). Puis nous avons tiré la chasse d’eau une seconde fois et prélevé de nouveau l’air. Nous avons attendu 5 minutes avant de fermer les boîtes de Pétri disposées autour des toilettes. Les différentes géloses ont ensuite été incubées à 37°C selon les conditions correspondant à chacune des bactéries (milieu Drigalski incubé à 37°C en atmosphère aérobie pendant 24 heures pour C. freundii, milieu GVPC incubé pendant 5 à 7 jours pour L. pneumophila et milieu ChromID® C. difficile incubé en atmosphère anaérobie pendant 48 heures pour C. difficile). Les colonies suspectes ont été identifiées par spectrométrie de masse de type Maldi-TOF6 (Bruker, Wissembourg, France). Toutes les données ont été enregistrées dans le logiciel Microsoft Excel© (Microsoft Corporation, Redmond, États-Unis). La relation entre l’intensité de la contamination des surfaces et de l’air (nombre total d’unités formant colonie [UFC] retrouvées dans les boîtes de Pétri pour chaque série de prélèvements c’est-à-dire 15 « surfaces » et 2 « airs ») et la concentration de bactéries dans l’échantillon d’eau du siphon (en log10 d’UFC/ml) a été analysée par régression linéaire et un coefficient de corrélation a été calculé (logiciel Stata® 16.0 [StataCorp, College Station, États-Unis]).
Résultats
Citrobacter freundii
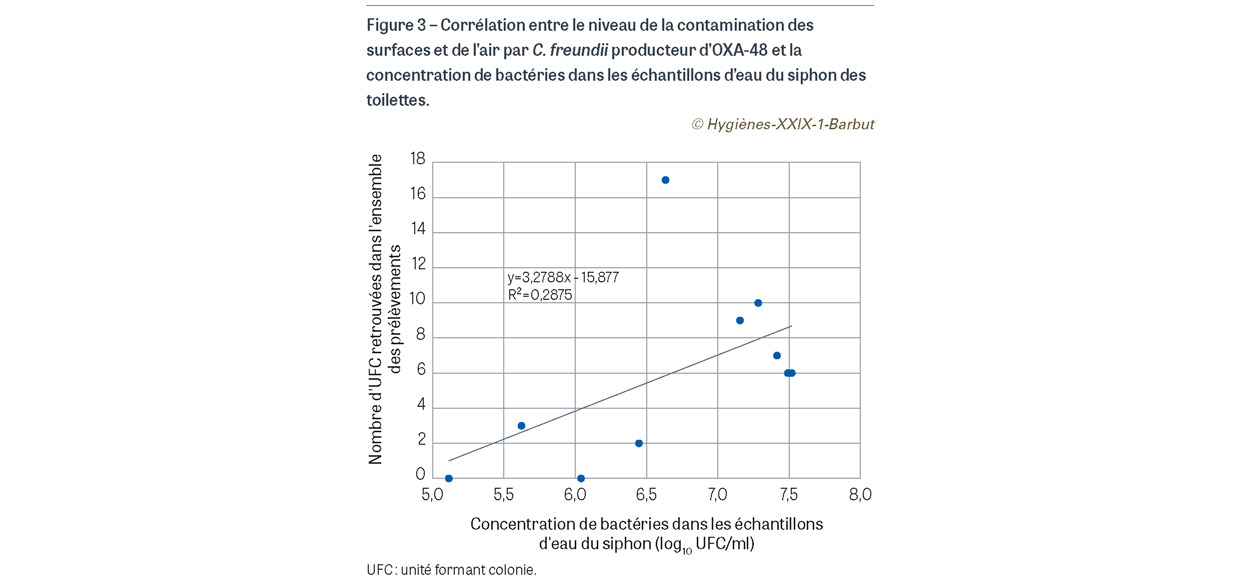
Au total, 10 séries de prélèvements ont été réalisées, soit 150 prélèvements de surface et 20 prélèvements d’air. Parmi eux, 25 (14,7%) étaient positifs à C. freundii producteur d’OXA-48 (24 prélèvements de surface et 1 prélèvement d’air) (Figure 2). La contamination allait d’1 à 8 UFC par prélèvement. On note que les prélèvements de surface effectués sur la cuvette des toilettes (positions 1 à 5) étaient plus fréquemment positifs que ceux situés à distance des toilettes (positions 6 à 15). Néanmoins, un prélèvement effectué à distance des toilettes (position 15) a également été retrouvé positif. Nous avons recherché une corrélation entre le niveau de la contamination des surfaces et de l’air (nombre total d’UFC retrouvées dans les boîtes de Pétri pour chaque série de prélèvements, c’est-à-dire 15 surfaces et 2 airs) et la concentration en bactéries dans l’échantillon d’eau du siphon (en log10 d’UFC/ml) (Figure 3). Les résultats suggèrent qu’à partir d’une certaine concentration (6,5 log10 UFC/ml), la contamination environnementale devient plus élevée (coefficient de corrélation : 0,45 ; p=0,11).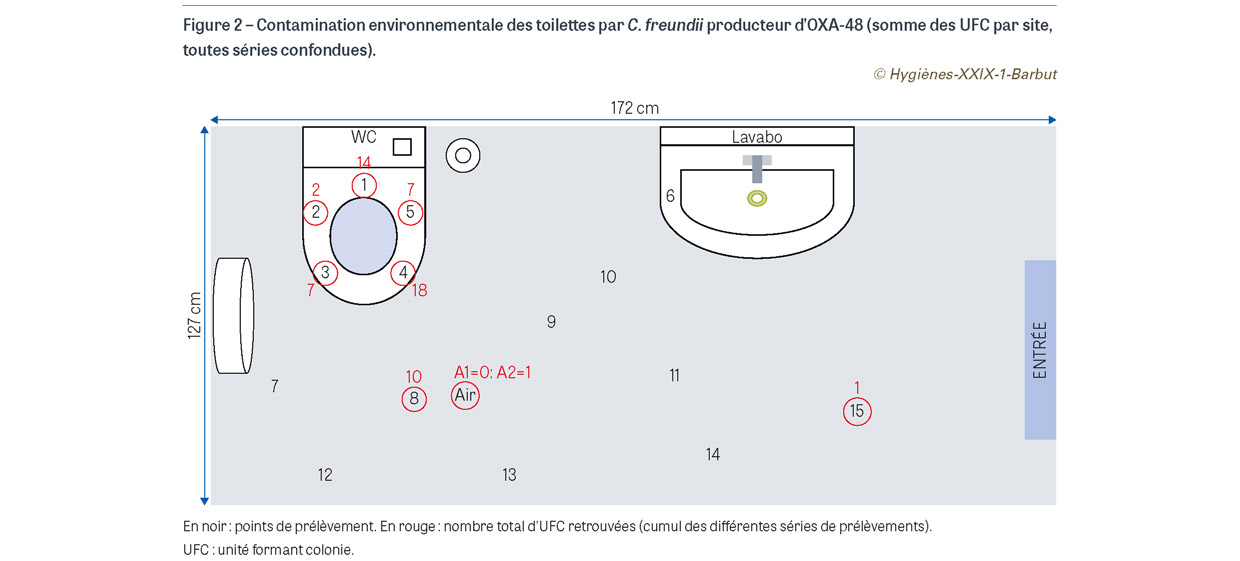
Clostridioides difficile
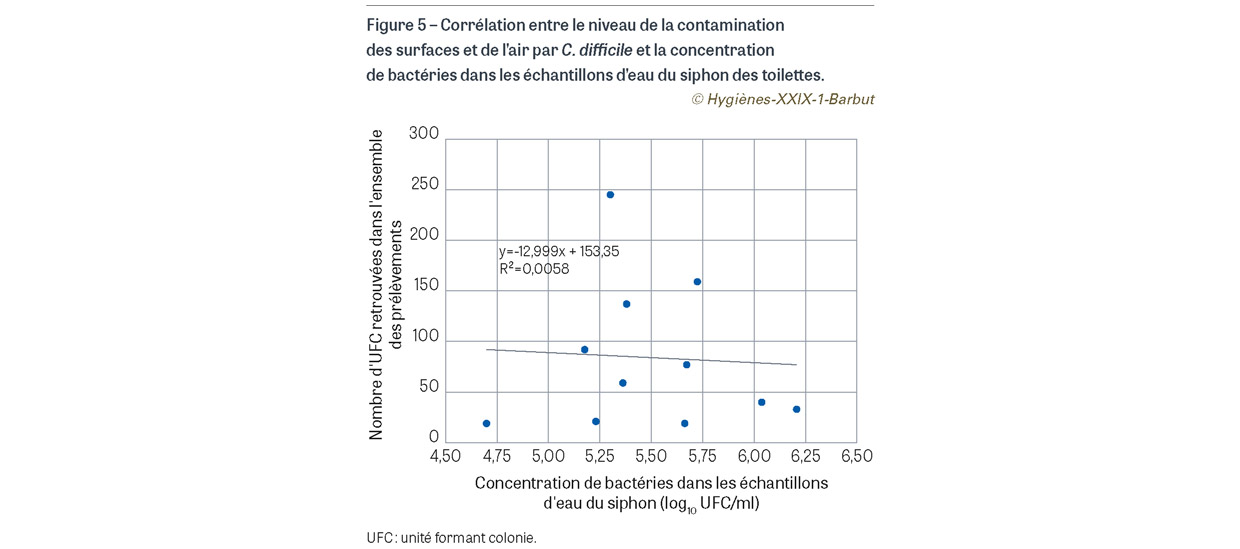
Au total, 11 séries de prélèvements ont été réalisées, soit 165 prélèvements de surface et 22 prélèvements d’air. Parmi ces prélèvements, 62 (33,2%) se sont avérés positifs à C. difficile (40 prélèvements de surface et 22 prélèvements d’air) (Figure 4). La contamination allait de 1 à 90 UFC pour les surfaces et de 3 à 111 UFC pour les prélèvements d’air. Il ne semble pas exister de corrélation entre le niveau de la contamination des surfaces et de l’air (nombre total d’UFC retrouvées dans les boîtes de Pétri) et la concentration en bactéries dans l’échantillon d’eau du siphon (en log10 d’UFC/ml) (coefficient de corrélation : -0,07 ; p=0,82) (Figure 5).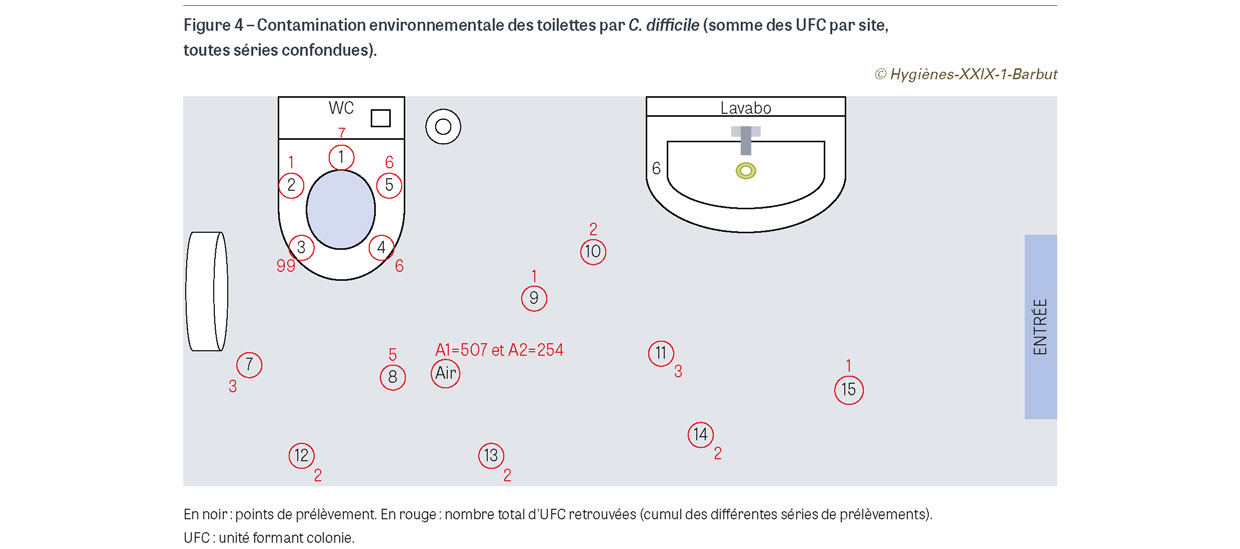
Legionella pneumophila
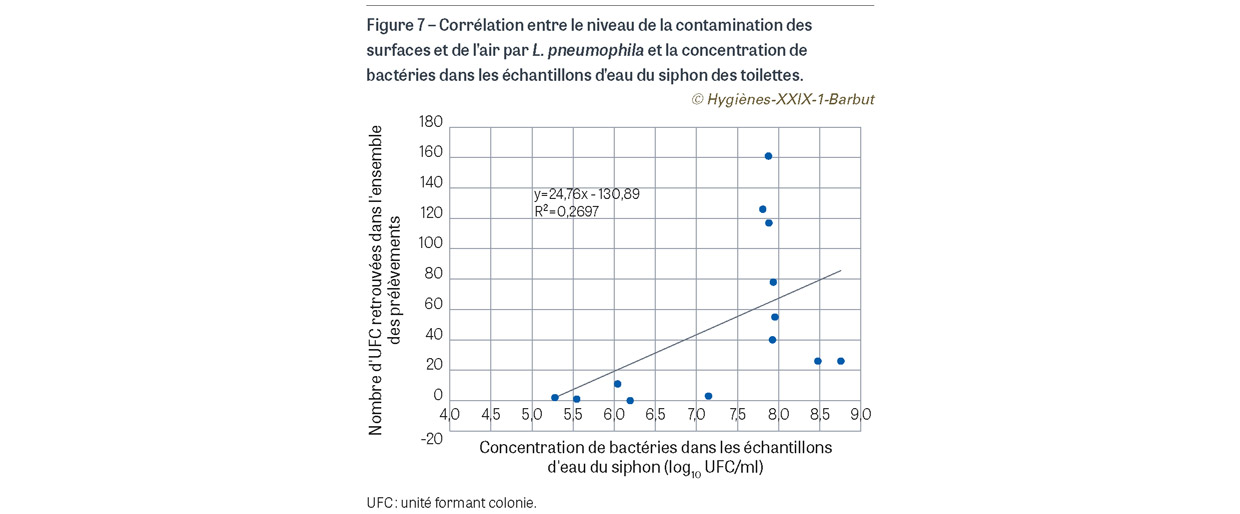
Au total, 13 séries de prélèvements ont été réalisées soit 195 prélèvements de surface et 26 prélèvements d’air (Figure 6). Parmi ces prélèvements, 72 (32,6%) se sont avérés positifs à L. pneumophila (59 prélèvements de surface et 13 prélèvements d’air). La contamination allait de 1 à 27 UFC par prélèvement de surface et de 1 à 85 UFC pour les prélèvements d’air. Les prélèvements situés sur la cuvette et les prélèvements d’air étaient les plus contaminés. Les résultats suggèrent qu’à partir d’une certaine concentration de bactéries (7,8 log10 UFC/ml), la contamination environnementale devient plus élevée (coefficient de corrélation : 0,51 ; p=0,069) (Figure 7). Nous avons aussi réalisé une série de prélèvements (15 surfaces et 2 airs) pour chacune des bactéries étudiées en laissant l’abattant des toilettes fermé avant de tirer la chasse d’eau. À l’exception d’un prélèvement positif à C. difficile au niveau de l’air (1 UFC), tous les autres sites de prélèvement se sont avérés négatifs.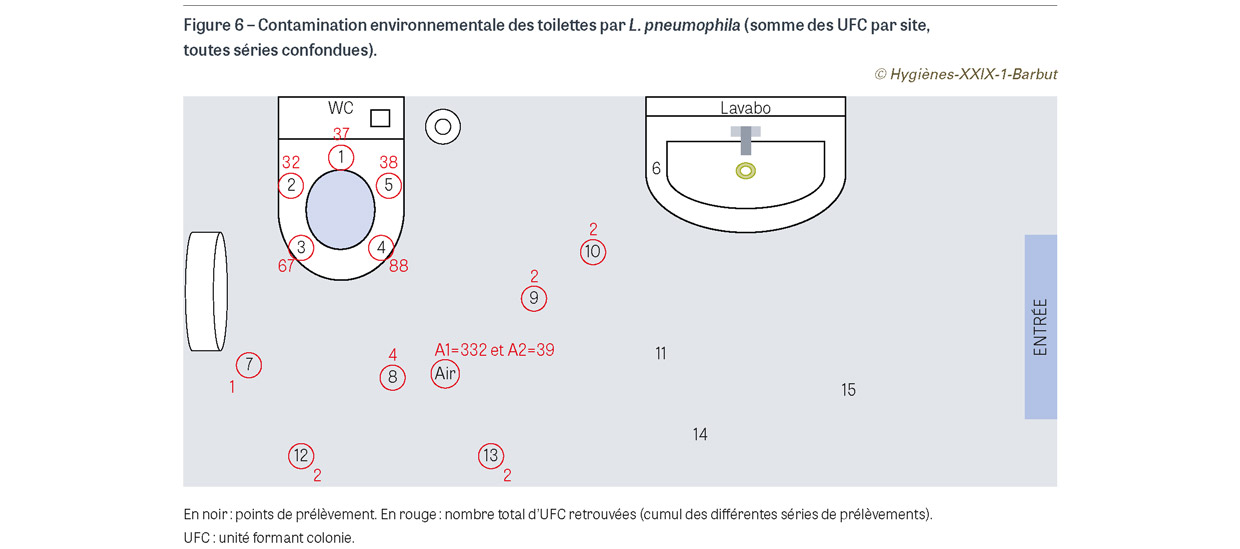
Discussion-conclusion
Les résultats de cette étude expérimentale suggèrent que les toilettes peuvent être à l’origine d’une dispersion de microgouttelettes d’eau et ainsi contaminer les surfaces situées à proximité. Cette observation expérimentale apporte un argument supplémentaire en faveur de l’hypothèse de transmission de C. freundii et L. pneumophila par le biais des toilettes au cours des épidémies survenues à l’hôpital Saint-Antoine. On savait que les légionelles pouvaient se transmettre par les aérosols générés par les tours aéroréfrigérantes, les turbines des dentistes, les bains à remous, les fontaines décoratives ou les douches. Les toilettes ont souvent été suspectées mais aucune étude n’avait jusqu’alors permis d’étayer cette hypothèse. La description de deux cas cliniques de légionellose nosocomiale survenus chez deux patients hospitalisés dans la même chambre mais à six mois d’écart et les résultats expérimentaux rapportés ici nous permettent d’incriminer les toilettes comme une source potentielle de contamination. La contamination environnementale par C. freundii producteur d’OXA-48 est plus originale et moins décrite dans la littérature, bien que des épidémies hospitalières liées à la contamination des siphons des lavabos par des entérobactéries productrices de carbapénémases aient été rapportées [7-9]. L’étude de Heireman et al. a montré une persistance de la contamination des toilettes par des entérobactéries productrices de carbapénémases pendant plusieurs mois malgré la désinfection quotidienne des siphons par de l’eau de Javel [8]. Après avoir expérimentalement contaminé des toilettes avec une souche de Serratia marcescens, Barker et al. [10] ont montré qu’une seule vidange diminuait de 2 log10 la quantité de bactéries présentes dans le siphon tout en étant responsable d’une contamination aérienne importante (103 UFC/ml) [9]. Nous confirmons ici que les toilettes peuvent aussi constituer un réservoir d’entérobactéries qui, à l’occasion du tirage de la chasse d’eau, sont une source de contamination de l’environnement à partir de laquelle le patient peut s’infecter. Enfin, concernant C. difficile, les toilettes sont à l’origine d’une très forte contamination à la fois qualitative et quantitative, confirmant les observations de Wilson et al. [11] qui ont montré que la vidange des toilettes de chambres de patients infectés par C. difficile était à l’origine de bio-aérosols importants contribuant à la contamination environnementale par cette bactérie. Une fois installée, la contamination des siphons des toilettes diminue avec le nombre de vidanges mais demeure difficile à éradiquer totalement car elle est encore détectable après 24 vidanges successives [12]. Compte tenu de l’étendue de la contamination aérienne, on peut imaginer que celle-ci puisse diffuser à l’extérieur des salles de bains et contribuer, par sédimentation, à la forte contamination environnementale des chambres de patients infectés constatée dans des études antérieures [13,14]. Ces observations soulignent l’importance de vérifier la ventilation des salles de bains par les VMC (ventilations mécaniques contrôlées) en milieu hospitalier et le taux de renouvellement d’air (au minimum 15 m3/h). Au vu de ces observations, il apparaît nécessaire de revisiter les mesures de prévention concernant l’utilisation des toilettes en milieu hospitalier. À l’hôpital Saint-Antoine, comme dans beaucoup d’autres établissements de soins, les abattants de toilettes ont été supprimés car ils étaient souvent mal entretenus par les agents hospitaliers. Cette étude suggère qu’il est important de pouvoir fermer l’abattant des toilettes avant de tirer la chasse d’eau afin d’éviter toute projection de microgouttelettes d’eau contaminée. Il convient de souligner que l’abattant n’est probablement pas suffisant pour prévenir la contamination de la lunette des toilettes elle-même et qu’il doit être désinfecté entre deux patients. Toutefois, notre étude présente certaines limites. En effet, nous avons travaillé avec des concentrations élevées de bactéries qui sont probablement éloignées des conditions physiologiques. À notre connaissance, la concentration de bactéries présentes dans l’eau des siphons des toilettes n’a jamais été rapportée. Nous avons constaté qu’il y avait pour certaines bactéries (C. freundii, L. pneumophila) une corrélation entre le niveau de contamination de l’eau des toilettes et la contamination des surfaces et de l’air, et que le risque de dissémination était plus faible en deçà d’une certaine concentration. Cependant, des toilettes mal entretenues génèrent du tartre, auquel les bactéries peuvent adhérer puis sur lequel elles peuvent produire un biofilm, ce qui entretient la contamination des siphons. Nous n’avons pas évalué la persistance au cours du temps de la contamination générée par la vidange des toilettes. Les prélèvements ont été réalisés cinq minutes après avoir tiré la chasse d’eau et représentent une vision instantanée de la contamination. Celle-ci peut évoluer au cours du temps en fonction de la survie des bactéries sur les différents types de surfaces mais aussi de la sédimentation des petites particules qui restent en suspension dans l’air plus longtemps. Enfin, nous avons utilisé dans cette étude des toilettes à réservoir, mais il existe d’autres mécanismes de tirage direct qui, visuellement, semblent générer davantage d’aérosols. En conclusion, cette étude expérimentale suggère que les toilettes représentent potentiellement un moyen de dissémination de bactéries dans l’environnement et une source de contamination pour les patients.
Notes :
1- Séquençage de génome complet.
2- Oxacillinase-48.
3- Buffered charcoal yeast extract, extrait de levure de charbon de bois tamponné.
4- Glycine, vancomycine, polymyxine, cycloheximide.
5- Impaction : projection de l’air aspiré sur une gélose.
6- Matrix-assisted laser desorption/ionization - time-of-flight mass spectometry: spectrométrie de masse à temps de vol pour la désorption-ionisation laser assistée par matrice.