Les mycobactéries non tuberculeuses (MNT) ou mycobactéries atypiques, parmi lesquelles Mycobacterium chimaera du complexe Mycobacterium avium (MAC), peuvent être responsables d’infections opportunistes chez des patients immunodéprimés ou en lien avec des pratiques médicales utilisant des dispositifs médicaux contaminés [1,2].
En avril 2015, le Centre européen de prévention et de contrôle des maladies (European Centre for Disease Prevention and Control [ECDC]) a lancé une alerte européenne sur la survenue de cas d’infection à M. chimaera après un acte de chirurgie cardiaque sous circulation extracorporelle (CEC) [3]. En 2018, la littérature fait état d’au moins 120 cas [4] déclarés par plusieurs pays européens (Royaume-Uni, Suisse, Allemagne, Pays-Bas, Irlande, France, Italie, Espagne) [5,6,7,8,9,10,11,12] et internationaux (États-Unis, Canada, Australie) [13,14]. Il s’agissait d’infections du site opératoire, le plus souvent d’endocardites sur valve prothétique, et/ou d’infections généralisées généralement sévères, avec un taux de mortalité très élevé, avoisinant les 50%.
En France, une enquête rétrospective menée en juin 2015 par Santé publique France, dans le cadre de cette alerte, a identifié deux cas confirmés d’infection à M. chimaera [15], selon la définition de cas de l’ECDC [16].
Les investigations menées au niveau international ont convergé pour démontrer le lien épidémiologique entre la survenue des cas et la production d’aérosols par des générateurs thermiques (GT) contaminés par M. chimaera utilisés pour la CEC [6,7,12,17,18]. La comparaison des souches cliniques et des souches retrouvées dans l’eau d’un type particulier d’une même marque de GT distribué dans différents pays a confirmé l’origine de la contamination [8,13,19]. Les GT utilisés pour réguler la température pendant la CEC, par échange thermique entre un circuit ouvert rempli d’eau filtrée et un circuit fermé dans lequel le sang circule, présentent, de par leur conception, de nombreuses caractéristiques les rendant susceptibles d’être colonisés par des germes de l’environnement : milieu aqueux, température élevée, système stagnant favorisant la production de biofilm [18,20]. Depuis cette alerte, les fabricants ont renforcé la procédure d’entretien et de contrôle microbiologique des GT de manière à en assurer une meilleure décontamination [21].
En 2017, une enquête, réalisée par Santé publique France et le Centre national de référence des mycobactéries et de résistance des mycobactéries aux antituberculeux (CNR-Myrma) et commanditée par le ministère de la Santé, avait pour objectifs : 1) de poursuivre la recherche rétrospective de cas d’infection à M. chimaera après une chirurgie cardiaque sous CEC, 2) de décrire les pratiques d’entretien et d’utilisation des GT pour la CEC par les établissements de santé (ES), et 3) de décrire les résultats des analyses microbiologiques de l’eau des GT réalisées dans le cadre des contrôles recommandés par les fabricants.
Matériels et méthodes
L’enquête a ciblé l’ensemble des ES qui pratiquaient des actes de chirurgie cardiaque sous CEC en France. Toutes les interventions de chirurgie cardiaque sous CEC ont été incluses.
Des questionnaires ont été adressés aux services de chirurgie cardiaque et aux équipes opérationnelles d’hygiène (EOH) des établissements concernés en juin et juillet 2017 ; les informations recueillies portaient sur la période du 1er janvier 2015 au 30 juin 2017. Le contenu du questionnaire s’appuyait sur les questions de l’ECDC1 posées pour l’évaluation du risque infectieux associé à M. chimaera de novembre 2016 [3,22]. Les questions portaient sur :
- les interventions de chirurgie cardiaque sous CEC en nombre de patients opérés et réopérés, notamment dans un contexte infectieux sous CEC ;
- les modalités de la surveillance des cas d’infection à M. chimaera selon la définition de cas de l’ECDC [13] ;
- les pratiques relatives à l’entretien des GT selon les principaux critères recommandés par les fabricants avant l’alerte lancée par l’ECDC en 2015 [23] et après l’alerte [21] (Tableau I) ;
- les difficultés rencontrées par les ES pour la mise en œuvre de la maintenance des GT ;
- les protections individuelles utilisées pendant la désinfection des GT ;
- les résultats des contrôles microbiologiques de la contamination des GT à la recherche de bactéries usuelles (c’est-à-dire flore totale aérobie revivifiable à 30 °C) et de mycobactéries atypiques (seule la contamination des GT par des MAC a été rapportée).
Les critères de conformité d’entretien des GT ont été analysés de manière groupée selon une méthode adaptée des bundles, méthode utilisée pour l’amélioration du processus de soins [24]. Les bundles correspondent à une méthode structurée et composée d’un ensemble cohérent de plusieurs pratiques bien définies, permettant d’obtenir un effet significatif, alors que chaque pratique appliquée seule ne le permet pas. Dans notre étude, le bundle de critères d’entretien des GT correspondait à l’ensemble des mesures recommandées par les fabricants : le renouvellement de l’eau des GT, la désinfection, la maintenance et le contrôle microbiologique. La vérification de la conformité avec le bundle de critères permet ainsi de vérifier la conformité des pratiques d’entretien des GT dans les ES avec celles recommandées par les fabricants.
Les réponses aux questions ouvertes ont été examinées via une analyse de contenu par classement thématique adaptée aux données qualitatives [25]. Les données quantitatives ont été analysées sous Stata©.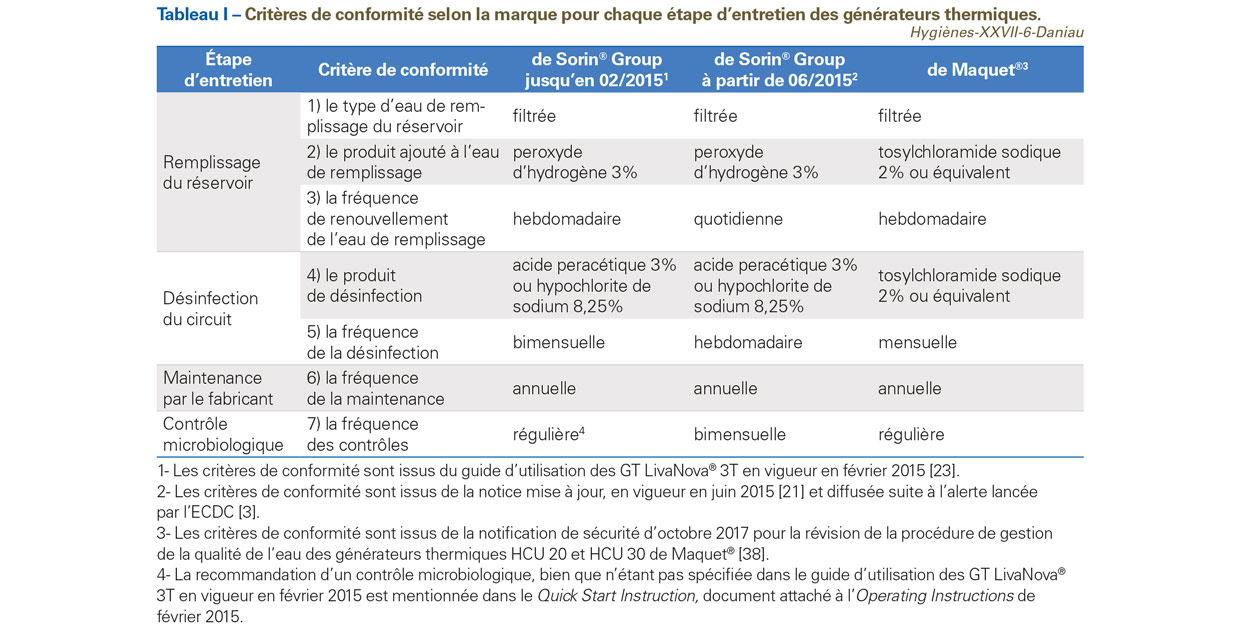
Résultats
Parmi les 61 services de chirurgie cardiaque sollicités, 56 ont participé à l’enquête, ce qui correspond à un taux de participation de 92%.
Interventions de chirurgie cardiaque sous circulation extracorporelle
Près de 40 000 interventions de chirurgie cardiaque ont été déclarées par les ES participants (Tableau II). Le taux d’incidence (TI) de patients réopérés dans un contexte d’endocardite infectieuse pour 100 interventions était sensiblement plus élevé dans le secteur public que dans le secteur privé, que ce soit en 2015 (TI=1,26 versus 0,46) ou en 2016 (TI=1,39 versus 0,53). Un prélèvement peropératoire pour la recherche de mycobactéries a été réalisé uniquement dans les établissements du secteur public chez un patient sur dix réopérés dans un contexte infectieux.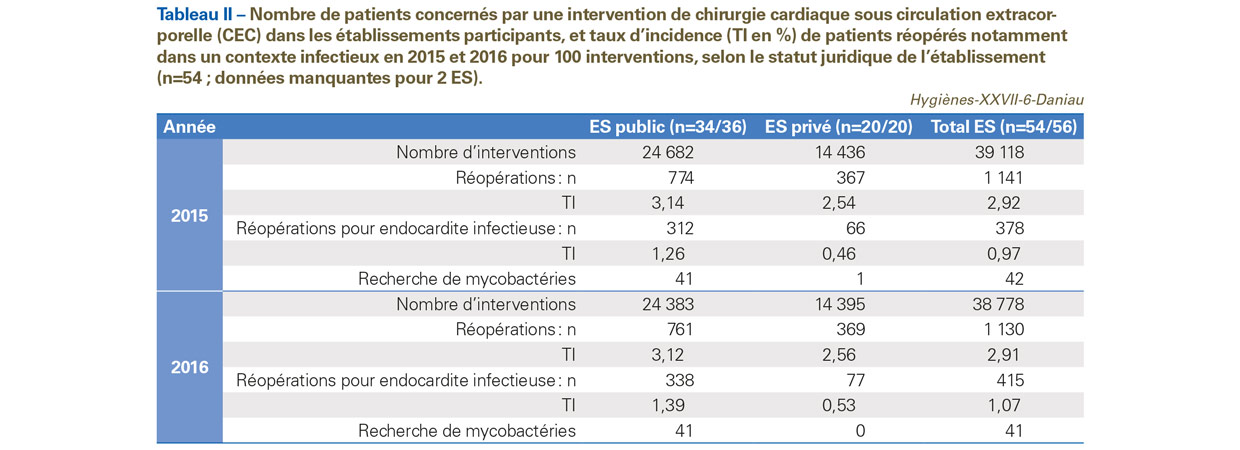
Recherche active de cas, suivi de patients et gestion du risque
Depuis janvier 2015, aucun établissement n’a déclaré de cas d’infection invasive à M. chimaera ou à MAC, alors qu’une recherche active de cas a été mise en œuvre par la moitié des ES répondants (29/56 ES, soit 52%). Il s’agissait d’une recherche rétrospective de cas à partir des dossiers patients et des résultats bactériologiques de laboratoires pour 30% des établissements participants (soit 17/56 ES). Une recherche prospective à partir du signalement de cas a été déclarée mise en œuvre par un quart des établissements (soit 14/56 ES). Enfin, un tiers des établissements (18/56 ES, soit 32%) a déclaré réaliser une recherche de MNT chez le patient en seconde intention en cas de diagnostic microbiologique d’endocardite et d’infection invasive après chirurgie cardiaque sous CEC.
Le suivi des patients ayant eu une chirurgie cardiaque avec usage peropératoire d’un GT restait encore marginal (5/56 ES, soit 9%). À l’inverse, les GT utilisés pour chaque intervention faisaient l’objet d’une traçabilité dans plus de la moitié des établissements (31/56 ES, soit 55%).
La majorité des établissements (50/56 ES, soit 89%) prenait des mesures préventives spécifiques au bloc opératoire, en plus des précautions standard, pour diminuer l’exposition des patients opérés au risque d’infection associé aux GT. Ces mesures portaient principalement sur l’orientation des flux de la ventilation des GT en direction des bouches d’extraction d’air ou le plus loin possible de la table d’opération (44/56 ES, soit 79%). Les autres mesures, telles que la soustraction des GT de la salle d’opération (4/56 ES, soit 7%) et la création d’une barrière physique autour du champ opératoire (3/56 ES, soit 5%) restaient exceptionnelles.
Parc de générateurs thermiques de circulation extracorporelle
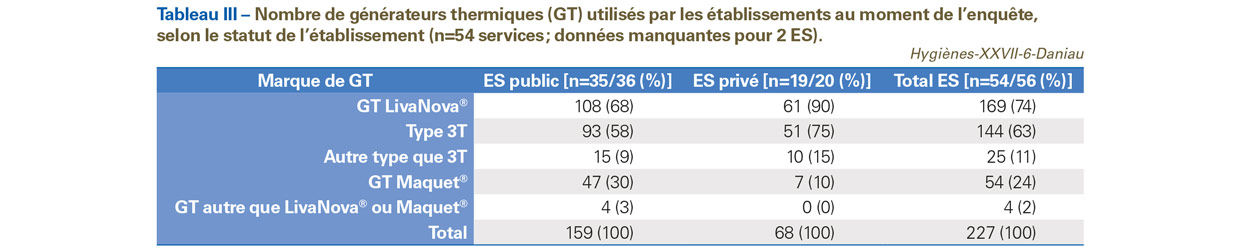
Au moment de l’enquête, l’utilisation de 227 GT toutes marques confondues a été déclarée par les ES participants, soit 5,8 GT en moyenne pour 1 000 interventions ou 4,2 GT en moyenne par ES. Les GT de la marque LivaNova® (ex-Sorin®) représentaient les trois quarts de ceux utilisés (169/227 GT, soit 74%) et étaient en majorité des modèles 3T (144/169 GT, soit 85%) (Tableau III).
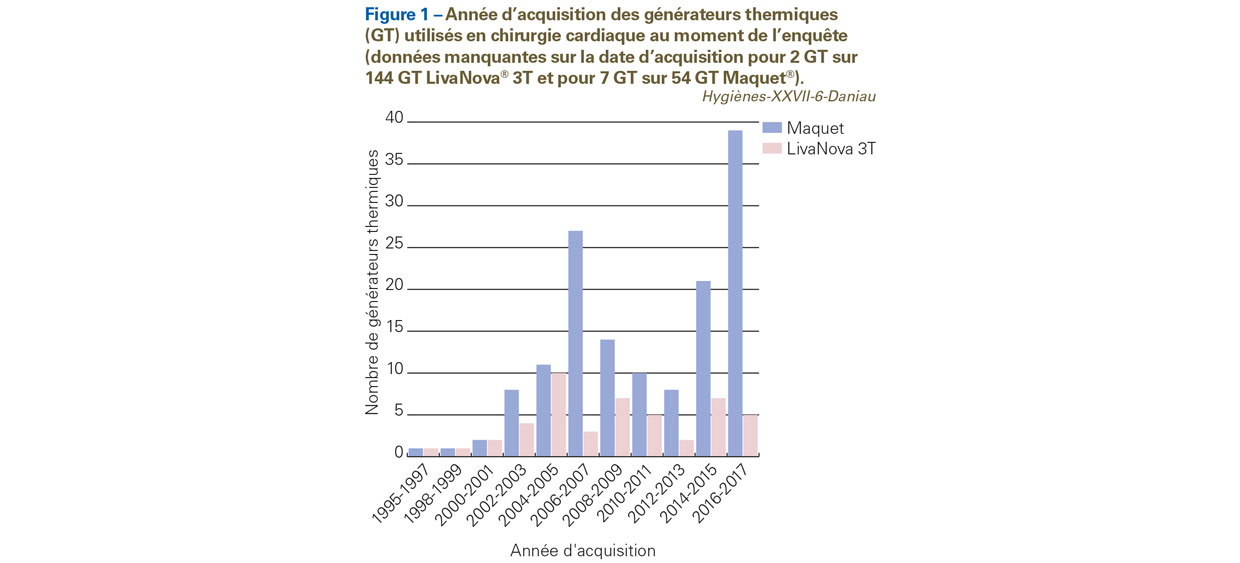
Environ un quart (39/144 GT, 27%) des GT LivaNova® de type 3T utilisés au moment de l’enquête avait été acquis après 2015 (Figure 1).
Pratiques relatives à l’entretien des générateurs thermiques
Au moment de l’enquête, la plupart des établissements ajoutaient un produit de désinfection à l’eau de remplissage du réservoir de leurs GT (86% soit 48/56 ES) et mettaient en œuvre la désinfection ou le détartrage de leurs GT (93% soit 52/56 ES). Cependant, en considérant la conformité des différentes étapes d’entretien des GT – le remplissage du réservoir (3 étapes), la désinfection ou le détartrage (2 étapes) et la maintenance (1 étape) –, telles que recommandées par les fabricants avant ou après l’alerte européenne sur les infections à M. chimaera [3,22], la proportion d’ES en conformité avec les recommandations était faible (Figure 2).
Ainsi, en agrégeant le bundle de critères de conformité sur l’entretien des GT (remplissage, désinfection et maintenance), sur les 28 ES qui étaient en conformité avec le remplissage des GT, 25 étaient également en conformité avec la désinfection des GT, et seulement 8 ES étaient également en conformité avec la maintenance des GT, soit au total 14% (8/56 ES) (Figure 2). Si l’on considère les recommandations postérieures à l’alerte européenne, 7% des établissements (4/56 ES) appliquaient les recommandations des fabricants.
Ce constat sur la conformité des établissements avec les recommandations des fabricants est en décalage avec les déclarations des établissements, qui considéraient pour deux tiers d’entre eux (soit 38/56 ES) appliquer l’entretien des GT suivant le protocole recommandé par le fabricant.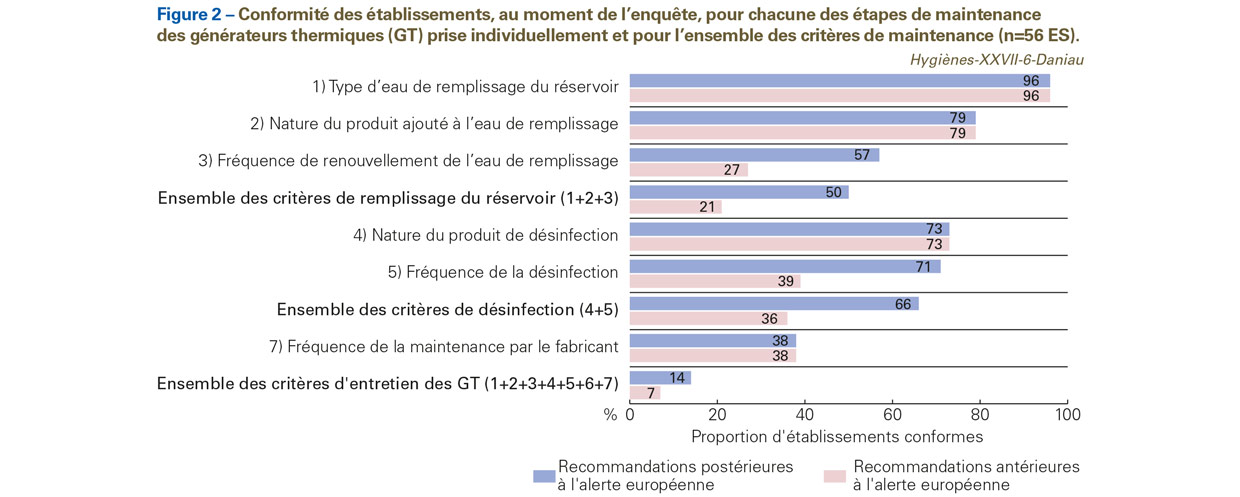
Pratique des contrôles microbiologiques de l’eau des générateurs thermiques
Au moins un contrôle microbiologique de l’eau du réservoir des GT avait déjà été réalisé, depuis 2015, par les trois quarts des ES (soit 42/56 ES) pour mesurer la flore totale. Parmi ces établissements, 38 réalisaient également des prélèvements pour la recherche de MNT. Cependant, en tenant compte de la fréquence bimensuelle des contrôles recommandée par le fabricant depuis l’alerte de l’ECDC, seulement trois ES (5%) étaient en conformité avec cette recommandation. Si l’on s’en tient à la recommandation antérieure à l’alerte ECDC (prélèvements réguliers de la flore totale), une majorité des ES (soit 59%, 33/56 ES) était en conformité avec celle-ci.
Au total, sur les qutres ES qui réalisaient le bundle de critères d’entretien des GT (remplissage du réservoir, désinfection et maintenance) de façon conforme aux recommandations postérieures à l’alerte ECDC, un seul établissement était également en conformité avec la recommandation pour les contrôles microbiologiques (trois ES réalisaient des contrôles microbiologiques à une fréquence non recommandée par le fabricant). En considérant les recommandations antérieures à l’alerte européenne, sur les huit ES en conformité avec les critères d’entretien des GT recommandés (remplissage du réservoir, désinfection et maintenance), six étaient également en conformité avec la recommandation pour les contrôles microbiologiques (soit 11% des ES).
Résultats des contrôles microbiologiques
Sur l’ensemble des GT ayant fait l’objet de prélèvements environnementaux dans l’eau de leur réservoir à la recherche de MNT, 56% étaient contaminés par des bactéries usuelles et 23% étaient contaminés par des MAC (Tableau IV). On note que sur l’ensemble des établissements ayant des GT contaminés par des MAC, près des deux tiers (soit 9/15 ES) ont adressé la souche au CNR-MyRMA.
Parmi les ES présentant au moins un de leurs GT contaminé par des bactéries usuelles (soit 28/41 ES disposant de résultats de contamination des GT), plus des trois quarts (79%, soit 22/28 ES) n’étaient pas en conformité avec les critères d’entretien des GT2. Cependant, cette proportion d’ES n’étant pas en conformité avec les recommandations était équivalente chez ceux ne présentant aucun de leur GT contaminé (77%, soit 10/13 ES).
La prise en compte des critères d’entretien plus rigoureux suite à l’alerte ECDC ne modifiait pas ce constat et la proportion d’ES n’étant pas en conformité restait quasiment identique parmi ceux présentant au moins un GT contaminé (89%, soit 25/28 ES) et ceux ne présentant pas de GT contaminé (85%, soit 11/13 ES).
Les mesures prises par ces établissements suite à la mise en évidence d’une contamination des GT par MAC étaient, pour 87% (soit 13/15 ES), l’arrêt de l’utilisation du GT concerné, sa désinfection immédiate et la réalisation de prélèvements de contrôle répétés afin de vérifier l’efficacité de la désinfection. Pour 40% (soit 6/15 ES), le GT contaminé était envoyé au fabricant pour une désinfection profonde, tandis que pour 47% (soit 7/15 ES), le GT contaminé était mis au rebut.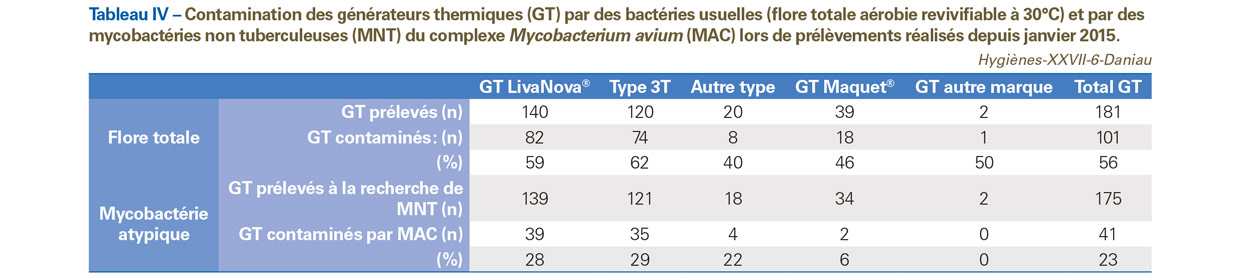
Difficultés rencontrées par les établissements pour l’application du protocole d’entretien des générateurs thermiques
Les 56 ES répondants exprimaient pour la plupart (86%, soit 48/56 ES) rencontrer des difficultés dans l’application du protocole d’entretien des GT (Tableau V). En particulier, la durée moyenne effective de la désinfection par appareil, égale à 3 h 20 min par mois, soit 15 h 50 min en moyenne par ES, représentait une charge de travail non négligeable.
Usage d’équipements de protection individuelle pendant la désinfection des générateurs thermiques
Parmi les 50 établissements ayant déclaré l’usage de matériel de protection lors de la désinfection des GT, la plupart utilisaient des gants de protection (46/50 ES). L’usage d’un masque recommandé pour cet usage était déclaré par presque la moitié des établissements (22/50 ES) ; le masque chirurgical étant parfois utilisé à tort pour la désinfection des GT (8/50 ES).
Des lunettes de protection étaient utilisées dans presque la moitié des établissements (24/50 ES) et une protection du corps (tablier, sarrau ou surblouse) était déclarée par un tiers des établissements (17/50 ES).
Enfin, six établissements précisaient réaliser la désinfection dans un local adapté avec évacuation de l’air et deux établissements utilisaient un procédé pour l’élimination des produits de désinfection (caisson).
Discussion
L’absence de cas d’infection invasive à M. chimaera, selon la définition de cas de l’ECDC, déclarée par les ES depuis 2015 est rassurante, notamment au regard des deux cas identifiés en France en 2012 et 2014. La plupart des autres pays européens dans lesquels cette épidémie s’est déclarée ont rapporté un nombre de cas plus élevé qu’en France : Royaume-Uni (30 cas), Suisse (10 cas), Allemagne (5 cas), Irlande (4 cas), Pays-Bas (4 cas). Ce résultat est à pondérer d’une part par le fait que seulement la moitié des ES a mis en place une recherche active de cas, et d’autre part par le fait que les patients réopérés dans un contexte infectieux font rarement l’objet d’un prélèvement peropératoire à la recherche de MNT, notamment dans le secteur privé. Pourtant, le message d’alerte rapide sanitaire (MARS) de 2015 recommandait d’effectuer une recherche de mycobactéries en seconde intention devant toute endocardite infectieuse ou infection de prothèse survenant après chirurgie cardiovasculaire réalisée sous CEC [26].
En revanche, une majorité d’ES a mis en place des mesures pour diminuer l’exposition des patients au risque infectieux associé à la présence de GT au bloc opératoire, en cohérence avec les demandes du MARS de 2017 [27].
L’incidence de patients réopérés pour une endocardite infectieuse reste faible, inférieure à 1%. Ces données sont nouvelles par rapport aux surveillances nationales qui concernent plus généralement la chirurgie cardiaque et coronaire [28].
Les deux tiers des ES déclarent appliquer l’entretien des GT suivant le protocole recommandé par le fabricant. En pratique, les étapes d’entretien des GT relevant du remplissage du réservoir et de la désinfection, prises individuellement, sont suivies par une majorité d’établissements. La maintenance des GT est l’étape d’entretien de ceux-ci la moins bien suivie (conforme dans un peu plus d’un ES sur trois). Au final, un nombre restreint d’établissements applique l’ensemble des étapes d’entretien recommandées : un ES sur sept si l’on considère les recommandations antérieures à l’alerte européenne et moitié moins si l’on considère les recommandations renforcées, postérieures à l’alerte.
Parmi les freins à la mise en œuvre des recommandations des fabricants, la charge de travail pour le personnel des ES liée à l’application des procédures renforcées d’entretien des GT (c’est-à-dire fréquence quotidienne de changement de l’eau des réservoirs et désinfection hebdomadaire [21]) est l’un des principaux [29]. En outre, la dangerosité des produits de désinfection et les risques pour les personnes exposées restent également une difficulté. Paradoxalement, l’usage d’équipements de protection individuelle pendant la désinfection des GT reste insuffisant. Enfin, des incertitudes quant à l’impact de la désinfection sur la durabilité des appareils ont également été exprimées par les ES et rapportées par certains auteurs [30].
Les contrôles microbiologiques étaient moins en conformité avec les recommandations des fabricants après (un ES sur dix) qu’avant (un ES sur deux) l’alerte européenne. Ce décalage entre les recommandations et les pratiques pose la question de la pertinence et de la faisabilité des mesures de prévention et des contrôles microbiologiques des GT.
L’identification microbiologique de M. chimaera à partir de prélèvements d’eau représente un défi pour les laboratoires d’analyses médicales [31]. Ainsi, en l’absence de méthode standardisée, les analyses microbiologiques spécifiques aux MNT en routine sont rarement proposées par les laboratoires. La recherche de MNT à la fréquence recommandée par les fabricants soulève en outre la question de sa pertinence. En effet, les MNT à croissance lente, comme M. chimaera requièrent au moins 7 jours et jusqu’à 2 mois pour former des colonies sur un milieu approprié [32]. Par ailleurs, dans ce contexte épidémique particulier, l’identification précise de la sous-espèce M. chimaera au sein du complexe MAC nécessite des tests spécifiques qui ne sont pas disponibles dans tous les laboratoires [33]. Ces paramètres d’analyse sont incompatibles avec la fréquence recommandée par les fabricants (bimensuelle pour les prélèvements et hebdomadaire pour la désinfection). En effet, comme le soulignent Fournier, et al. : « que faire des résultats qui ne sont disponibles que plusieurs semaines après le prélèvement. Entre-temps le GT aura subi plusieurs cycles de désinfection, les rendant obsolètes » [34].
Les prélèvements microbiologiques réalisés retrouvaient une flore abondante, incluant des mycobactéries. D’autres auteurs observent également une contamination fréquente des GT [12].
La majorité des GT utilisés correspondaient au type spécifiquement lié à l’épidémie [19], dont la contamination par des mycobactéries dans notre enquête (29%) était, néanmoins, moindre que celle observée par d’autres études : 77% des GT (soit 27/35 GT) au Royaume-Uni [12].
Lorsque l’on recoupe la conformité de l’entretien des GT et leur niveau de contamination, on constate que les ES qui effectuent un entretien de ceux-ci conformément aux recommandations des fabricants présentent, malgré tout, des GT contaminés à MAC. L’absence d’une décontamination efficace des GT a été mise en évidence dès 2002, avant l’existence des recommandations des fabricants [20]. Depuis, certains auteurs constatent un échec de la décontamination [6,12,29]. Le développement des mycobactéries persiste dans le réservoir des GT malgré l’usage de peroxyde d’hydrogène et le changement régulier (bimensuel) de l’eau des GT [6]. De même, plusieurs études rapportent des difficultés pour garder les GT exempts de contamination malgré des protocoles d’entretien intensifs [35,36,37]. La désinfection ne permet pas de maîtriser totalement la contamination des GT, notamment par M. chimaera [36]. Götting, et al. constatent la détection systématique de M. chimaera dans les réservoirs de GT, malgré les recommandations en vigueur pour l’entretien de ceux-ci [18]. Garvey, et al. montrent que plusieurs cycles successifs de désinfection sont nécessaires pour réduire la charge microbiologique dans les réservoirs des GT, sans toutefois supprimer totalement la contamination [35]. Une augmentation de la concentration de la flore totale quelques semaines après la désinfection suggère une part irréductible de la contamination associée au biofilm [35].
Limites de cette enquête
Malgré une participation quasi exhaustive des ES grâce à la collaboration des EOH et des services de chirurgie cardiaque, cette enquête présente certaines limites. Il s’agit d’une enquête déclarative et les biais de déclaration sont toujours possibles. Concernant les questions sur les pratiques d’entretien des GT, la perte d’informations associée aux données manquantes a tendance à diminuer de manière artificielle les proportions de conformité.
Par ailleurs, les données relatives aux résultats microbiologiques de prélèvements de l’eau des GT à la recherche de mycobactéries depuis 2015 sont susceptibles d’être sous-estimées du fait de leur recueil rétrospectif. En outre, l’absence d’information sur les conditions dans lesquels ces prélèvements ont été réalisés est préjudiciable pour l’interprétation des résultats (protocole de prélèvement, et prélèvement avant un cycle d’entretien ou prélèvement après un ou plusieurs cycles d’entretien).
Conclusion
Lors de cette enquête, aucun nouveau cas d’infection à M. chimaera après un acte de chirurgie cardiaque sous circulation extracorporelle (CEC) n’a été identifié depuis 2015. Les publications internationales récentes montrent que l’épidémie d’infections à M. chimaera était associée à une contamination lors de la fabrication des appareils [19].
Cette enquête montre que des progrès sont encore à faire pour la recherche active de cas, la recherche de MNT en peropératoire devant toute endocardite infectieuse et la désinfection des GT, malgré une diffusion large des MARS de 2015 et 2017 [26,27].
Les mesures de désinfection des GT et les prélèvements d’eau de ceux-ci sont pratiqués de façon inégale et rarement en conformité avec les recommandations des fabricants pour la désinfection des GT. Néanmoins, ces dernières semblent difficilement applicables, en particulier concernant les prélèvements microbiologiques. Ceux réalisés retrouvent une flore abondante, incluant des mycobactéries. Les difficultés rencontrées par les ES pour la mise en œuvre de l’entretien des GT en conformité avec les recommandations des fabricants et l’absence de lien démontré entre les procédures recommandées et le risque infectieux suggèrent la nécessité de recommandations nationales fondées sur l’analyse de la littérature et l’avis d’experts. Le Haut conseil de la santé publique doit être saisi par le ministère de la Santé dans ce sens.
Notes :
1- Questionnaire ECDC d’octobre 2016 : Mycobacterium chimaera questionnaire for epidemiological update.
2- Critères d’entretien des GT relevant du remplissage du réservoir, de la désinfection et de la maintenance des GT (selon les recommandations antérieures à l’alerte ECDC).