En France, les infections du site opératoire (ISO) se situent au troisième rang des infections associées aux soins (IAS) selon la dernière enquête nationale de prévalence des infections nosocomiales réalisée en 2012 et portant sur 300 330 patients hospitalisés. Dès 1988, l’organisation de la lutte contre les infections nosocomiales et les programmes successifs de prévention ont fixé un objectif de réduction des ISO en s’appuyant sur la publication du SENIC Project qui avait montré que cette réduction atteignait 20 % dans les services ayant mis en place une surveillance avec rétro-information aux équipes chirurgicales et des mesures préventives spécifiques [1]. La gestion du risque infectieux chez l’opéré a fait l’objet en France de nombreuses recommandations, dont celles de la Société française d’hygiène hospitalière (SF2H) (conférence de consensus en 2004 et sa réactualisation en 2013, qualité de l’air au bloc opératoire et en secteur interventionnel en 2015) [2,3,4], de la Société française d’anesthésie réanimation pour l’antibioprophylaxie chirurgicale (en cours de réactualisation) [5], de la Société de pathologie infectieuse de langue française portant sur la prise en charge des infections ostéo-articulaires après mise en place de prothèse [6] et de nombreux guides des Cclin-Arlin. En novembre 2016, l’Organisation mondiale de la santé (OMS) publie, sous la forme d’un guide (accompagné de vingt-sept annexes et deux articles), des lignes directrices mondiales pour la prévention des ISO [7,8,9,10]. Quelles sont les nouveautés apportées aux hygiénistes par le guide de l’OMS en limitant cette question à la préparation cutanée préopératoire (douche, dépilation, décolonisation), à l’antisepsie du champ opératoire (détersion, antisepsie proprement dite) et au traitement de l’air en salle d’intervention ?
Résumé du guide
En introduction le groupe de travail rappelle que de nombreux facteurs de risque interviennent dans la survenue d’une ISO, ce qui rend complexe sa prévention car elle nécessite l’association de nombreuses mesures tout au long de la prise charge chirurgicale du patient. Les auteurs notent l’absence de mesures standardisées au sein d’un guide international et l’identification de la faiblesse des argumentaires et de l’interprétation des preuves scientifiques dans les guides nationaux disponibles.
Le guide s’adresse à la prévention des ISO quel que soit l’âge du patient, mais il est précisé le manque de preuves scientifiques en pédiatrie pour certaines recommandations, voire leur non-applicabilité. Les critères de jugement des études retenues pour établir les recommandations sont la survenue d’une infection (taux d’ISO) et la mortalité attribuable à ces infections. La méthodologie retenue pour l’élaboration du guide comprend : a) l’identification des thèmes prioritaires et la formulation d’une série de questions structurées autour des critères de la méthode Grade (population, intervention, comparaison, résultats) [11] ; b) la recherche de preuves scientifiques au travers de revues systématiques pour chaque thème selon une méthode standardisée ; c) l’évaluation et la synthèse des preuves ; d) la formulation des recommandations ; e) la rédaction du contenu du guide et la planification de sa diffusion.
La recherche bibliographique au sein des différentes bases de données a pris en compte les articles publiés depuis 1990 en anglais, français et espagnol, mais sans restriction pour d’autres langues ; les revues systématiques ont été menées entre décembre 2013 et décembre 2015.
Le niveau global de la preuve a pris en compte le niveau de preuve de l’ensemble des critères retenus et des critères essentiels ayant le niveau de preuve le plus faible. Ainsi, la certitude de la proximité entre l’effet réel (de la mesure) et l’effet estimé est présentée selon quatre grades : haut, moyen, bas, très bas.
Les recommandations sont présentées selon deux classes : a) « fortes », adaptables pour leur mise en œuvre dans la plupart des situations (sinon toutes), et la mesure considérée comme devant être appliquée aux patients ; b) « conditionnelles », un processus décisionnel plus structuré devant être entrepris en concertation avec les professionnels concernés avec la participation des patients ; pour nombre d’entre elles, il est ajouté d’importantes remarques concernant les implications en termes de moyens disponibles et de faisabilité pour les pays aux ressources limitées.
En l’absence de consensus, une recommandation est mise au vote et approuvée après avis favorable de la majorité des membres du groupe d’experts.
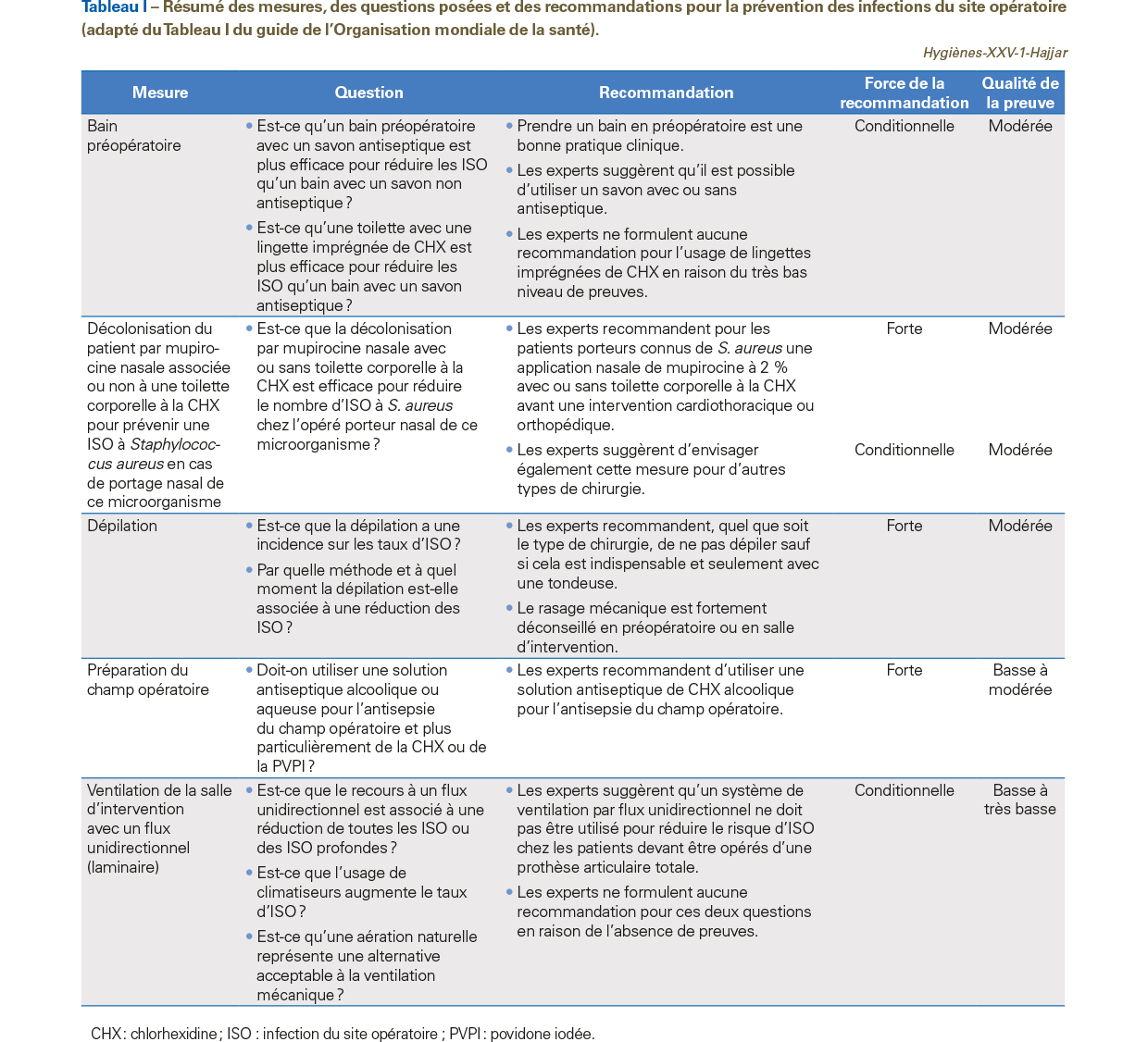
Au total 29 recommandations ont été formulées ; seules figurent dans le Tableau I celles faisant l’objet de commentaires dans cet article.
L’OMS accueille favorablement les suggestions pour les futures mises à jour de ce guide.
Commentaires
Méthodologie d’élaboration des recommandations
Le guide de l’OMS souligne la faiblesse des argumentaires et de l’interprétation des preuves scientifiques dans les guides nationaux disponibles. Il importe de réfuter ce constat pour les recommandations françaises qui s’appuient sur les méthodologies établies par la Haute Autorité de santé et appliquées par l’ensemble des sociétés savantes impliquées dans la gestion du risque infectieux chez l’opéré. Selon les preuves scientifiques disponibles, les méthodes structurées font appel soit à une conférence de consensus, soit à un consensus formalisé d’experts, soit à une recommandation pour la pratique clinique. À titre d’exemple, pour la réactualisation de la conférence de consensus Gestion préopératoire du risque infectieux la méthodologie est particulièrement détaillée. Chacun des thèmes retenus a fait l’objet de sous-questions posées. La méthode Grade a été utilisée pour les questions comportant des stratégies alternatives permettant d’évaluer son niveau de preuve à partir de la qualité des articles (hétérogénéité, imprécision, présence d’une mesure indirecte et mise en évidence d’un probable biais de publication). Les méta-analyses existantes ont été mises à jour, si besoin, en prenant en compte la littérature récente. La survenue d’une infection (taux d’ISO) est le critère principal de jugement retenu dans le guide de l’OMS. D’une part de nombreuses études se basent sur le critère colonisation associé ou non à la présence d’une infection. D’autre part les taux d’infection restent d’interprétation difficile en raison du caractère multifactoriel d’une ISO et de la disparité des définitions utilisées pour ce critère de jugement. Alors même que nous disposons d’une expertise nationale solide tant au niveau de la surveillance des ISO (et de leurs aspects épidémiologiques) que de l’expérience de terrain et de la maîtrise de l’élaboration de recommandations, on ne peut que déplorer l’absence d’hygiénistes français dans le groupe d’experts rédacteurs ou relecteurs du guide de l’OMS. On note également que les tableaux illustrant les recommandations existantes pour la gestion du risque infectieux opératoire omettent celles élaborées en France.
Préparation cutanée préopératoire (douche, dépilation, décolonisation)
Douche préopératoire
Le guide de l’OMS n’apporte aucune nouveauté pour cette mesure. La conférence de consensus de la SF2H en 2004 avait rappelé l’importance de la réalisation d’au moins une douche préopératoire [2]. L’actualisation des recommandations en 2013 laisse le choix quant au type de savon à utiliser (qui peut être antiseptique ou non) et préconise la réalisation systématique d’un shampoing dès lors que le cuir chevelu est dans le champ opératoire (avis d’experts) [3]. L’initiative du choix du savon étant laissée à l’équipe chirurgicale, la douche avec un savon antiseptique peut se justifier pour les interventions chirurgicales considérées à haut risque infectieux (cardiaque, orthopédique, neurochirurgicale, et toute chirurgie avec prothèse ou implant), lorsqu’un antiseptique en solution alcoolique n’est pas utilisable et pour les patients à risque particulier (absence d’hygiène corporelle, précarité, non-autonomie). Le guide de l’OMS et les recommandations françaises ne formulent aucune recommandation sur l’utilisation de tissus imprégnés pour la réalisation de la douche préopératoire.
Dépilation
Le guide de l’OMS n’apporte aucune nouveauté pour cette mesure. Les recommandations françaises sont claires depuis de nombreuses années : il est recommandé de ne pas pratiquer de dépilation (rasage mécanique, tonte ou dépilation chimique) en routine. Si la dépilation est utile, il est recommandé de privilégier la tonte et fortement recommandé de ne pas recourir au rasage mécanique.
Décolonisation
La nouveauté du guide de l’OMS est l’extension de la décolonisation des porteurs connus de Staphylococcus aureus à tout type de chirurgie. En effet, les experts de l’OMS recommandent fortement une décolonisation du portage connu par application nasale de mupirocine à 2 % associée ou non à une toilette corporelle à la chlorhexidine (CHX), chez les patients devant bénéficier d’une chirurgie cardiothoracique ou orthopédique, et ils suggèrent d’étendre cette recommandation à tout autre type de chirurgie. La qualité de la preuve de ces recommandations est de niveau modéré, en se basant sur six essais randomisés contrôlés menés entre 2002 et 2013 et portant sur différents types de chirurgie [12,13,14,15,16,17] ; les experts ont considéré que les résultats, en termes d’efficacité, étaient superposables quelle que soit la classe de chirurgie. Les autres études se rapportent à l’hémodialyse et aux bactériémies. La formulation de cette mesure suppose un dépistage, mais les experts ne donnent aucune précision sur les modalités de dépistage des patients et de l’administration de mupirocine (fréquence et durée). Le guide souligne la problématique de la résistance à la mupirocine et les réactions d’irritation, voire de choc anaphylactique, liées à la CHX. Cette extension de la décolonisation à tout type de chirurgie est discutable lorsque l’on examine l’argumentaire du groupe de travail de la SF2H qui a procédé à des méta-analyses séparées (portant au total sur sept essais randomisés dont ceux décrits dans le guide de l’OMS) pour statuer séparément sur la chirurgie cardiaque, la chirurgie orthopédique, les autres actes chirurgicaux de classe propre et les actes de classe propre-contaminée ou sale. Seule la décolonisation du portage de Staphylococcus aureus chez les patients bénéficiant d’une chirurgie cardiaque est recommandée [3]. Pour ce qui est des autres actes chirurgicaux, aucune recommandation n’a pu être émise sur le bénéfice de cette mesure. La décolonisation nasale par mupirocine doit débuter au plus tard la veille de l’intervention chirurgicale et il est recommandé d’y associer une décolonisation corporelle et oropharyngée par un produit antiseptique efficace contre S. aureus (sans précision sur la molécule antiseptique à utiliser). L’application de cette mesure ne nécessite aucun dépistage préalable car « la décolonisation universelle sans dépistage est davantage coût/efficace que la décolonisation ciblée des seuls patients dépistés positifs, apparaît plus simple à mettre en œuvre et permet de décoloniser tous les patients porteurs de S. aureus ». Les experts français ont également souligné que « la décolonisation des seuls patients dépistés positifs permet de respecter les principes de bon usage des antibiotiques et de limiter le risque d’émergence de la résistance ».
Antisepsie du champ opératoire (détersion, antisepsie proprement dite)
Détersion
Le guide de l’OMS n’aborde pas ce thème. Cette mesure fait l’objet d’approches différentes. Les orthopédistes nord-américains en 2014 recommandent la détersion avec un savon antiseptique pour les arthroplasties de hanche ou de genou [18]. Le Conseil supérieur de la santé belge stipule en 2014 que « quelle que soit la préparation préalable à l’intervention chirurgicale, une détersion de la zone opératoire se fera à l’aide d’une solution moussante suivie d’un rinçage et d’un séchage. La détersion permet de diminuer la quantité de squames et débris cutanés présents sur la zone d’incision, avant l’application de l’antiseptique » [19]. En 2014, la Société américaine d’épidémiologie en santé (SHEA) recommande de « laver et nettoyer la peau autour du site d’incision, avant de réaliser une antisepsie avec un produit en solution alcoolique » [20]. Dans le document de la SF2H réactualisant en 2013 la gestion préopératoire du risque infectieux, aucune recommandation n’a été émise concernant la détersion avant la réalisation d’une antisepsie sauf si la peau est souillée. En l’absence de preuve solide en faveur ou en défaveur d’une détersion systématique avant une antisepsie, des arguments plaident pour son maintien, notamment le fait qu’une peau souillée n’est pas obligatoirement contaminée et qu’une peau non souillée n’est pas exempte de microorganismes. D’autre part, la seule étude testant l’efficacité de plusieurs antiseptiques selon un test ex vivo conduite par Messager en 2001 montre que, dans le meilleur des cas, il est obtenu un abaissement de 2 à 3 logs de la contamination bactérienne (alors que les normes in vitro exigent une réduction de 5 logs) [21]. Ainsi, l’étape de détersion ou nettoyage permet de réduire l’inactivation des antiseptiques par les matières organiques (pus, sang, sérosités, sueur, sébum) et de renforcer l’action antiseptique en abaissant le nombre de microorganismes « naturellement » présents sur la peau.
Antisepsie proprement dite
La nouveauté du guide de l’OMS ne réside pas dans la recommandation d’un antiseptique en solution alcoolique pour l’antisepsie du champ opératoire mais dans celle de l’utilisation préférentielle de la CHX. Les experts de l’OMS se basent sur six essais randomisés contrôlés comparant la CHX à la povidone iodée (PVPI), les deux produits étant en solution alcoolique (annexe VIII du guide) [22]. Ils précisent que la plupart de ces essais montrent soit l’absence de différence entre les deux produits [23,24], soit l’absence de survenue d’ISO [25,26]. Seuls deux essais retrouvent une augmentation du risque d’ISO dans le bras PVPI [27,28]. L’étude de Berry montre une différence significative à la sortie du patient, mais pas à trois-quatre jours (27/389 soit 6,9 % dans le groupe CHX vs 35/354 soit 9,9 % dans le groupe PVPI) et aucun suivi à un mois n’est fourni. L’étude de Veiga, qui ne comprenait que 125 patients dans chaque bras, retrouve quatre ISO dans le groupe PVPI avec une différence à la limite de la significativité (p = 0,06) qui n’aurait pas existé (p = 0,12) si les auteurs avaient utilisé un test de Fisher bilatéral et non un test unilatéral. Une méta-analyse de ces études montre une réduction significative du risque d’ISO lorsque la CHX alcoolique est utilisée. Cependant dans quatre essais sur six, aucune ISO n’est retrouvée dans au moins un des bras de l’étude et dans la plupart le critère principal de jugement est la colonisation et non l’infection [23,24,26]. Parmi les six études citées, on note un lien d’intérêt pour deux d’entre elles avec des industriels commercialisant la CHX. Bien que la limite d’inclusion dans la bibliographie fût fixée au mois d’août 2016, le groupe d’experts a inclus l’étude de Tuuli publiée en 2016. Il s’agit d’un essai monocentrique, randomisé, comparant la CHX 2 % alcoolique à la PVPI alcoolique, pour la césarienne ; sauf urgence, l’antisepsie est précédée d’une détersion ; sur les 1 636 femmes éligibles, 1 147 ont été incluses (30 % d’exclusion) entre septembre 2011 et juin 2015 (biais potentiel lié à la durée de l’étude sur près de quatre ans) ; si le taux global d’ISO est en faveur de la CHX, il n’y a aucune différence significative lorsque l’on examine séparément les ISO superficielles (p = 0,10) et profondes (p = 0,07). Il est surprenant que les experts ne se soient pas intéressés à l’étude antérieure de Ngai publiée en 2015, qui compare dans un essai randomisé la CHX-OH et la PVPI-OH dans la prévention des ISO après césarienne (un des deux antiseptiques seul ou les deux associés) ; les auteurs concluent à l’absence de différence significative des taux d’ISO entre CHX (4,5 %) et PVPI (4,6 %) seuls ou associés (3,9 %) [29]. Au total, ces experts jugent le niveau de qualité de la preuve bas en raison des biais et imprécisions des essais, mais recommandent fortement l’usage préférentiel de la CHX ! La Food and Drug Administration a récemment alerté les professionnels et les usagers sur les cas de réactions allergiques graves survenant avec la CHX [30]. Cette mise en garde vient conforter le nombre d’irritations cutanées en rapport avec l’usage de concentrations élevées de CHX [31] et l’émergence croissante de la résistance à cet antiseptique liée à son utilisation large (solutions pour bains de bouche et lentilles de contact, produits cosmétiques, dentifrice, etc.) et à l’impact sur la sélection de souches résistantes aux antibiotiques [32]. La SF2H en 2013 recommande fortement d’utiliser un antiseptique en solution alcoolique sans se prononcer sur la molécule antiseptique ; cette recommandation est confirmée dans le guide Antisepsie de la peau saine avant un geste invasif chez l’adulte. Recommandations pour la pratique clinique publiée en mai 2016 [33].
Traitement de l’air en salle d’intervention
Les experts de l’OMS suggèrent de ne pas utiliser un système de ventilation par flux unidirectionnel pour réduire le risque d’ISO chez les patients devant être opérés d’une prothèse articulaire totale. Il est pour le moment impossible d’analyser de manière détaillée l’argumentaire à la base de cette recommandation car le guide renvoie à l’annexe 24 non encore publiée (Appendix 24: Bischoff P, et al. Impact of laminar airflow ventilation on surgical site infections: a systematic review and meta-analysis. Lancet Infectious Diseases, in press). On rappelle la recommandation de la SF2H en 2015 de mettre en place un traitement de l’air avec flux unidirectionnel en chirurgie orthopédique prothétique pour diminuer l’aérobiocontamination. Ce traitement de l’air vient en complément de l’antibioprophylaxie qui joue un rôle essentiel dans la prévention de l’infection pour ce type de chirurgie [4]. Le groupe de travail avait ajouté le commentaire suivant : « L’antibioprophylaxie joue un rôle majeur dans la prévention des ISO pour les interventions de classe I avec pose d’implant ou de prothèse ; le rôle du traitement de l’air est complémentaire en chirurgie orthopédique prothétique. Le bénéfice de la synergie entre ces deux méthodes de prévention des ISO est faible. La littérature est quasi inexistante dans les autres types de chirurgie ». Comme cela a été publié en 2009, la baisse du taux des ISO en France est estimée à 30 % par le réseau national de surveillance [34] ; cette baisse pourrait être associée, au moins en partie, à l’application par les équipes chirurgicales des mesures recommandées de prévention du risque infectieux chez l’opéré : douche préopératoire (avec un savon antiseptique pour les actes chirurgicaux à haut risque), absence de dépilation (et si besoin à réaliser uniquement avec une tondeuse), décolonisation nasale à la mupirocine pour les interventions de chirurgie cardiaque, antisepsie du champ opératoire avec un antiseptique en solution alcoolique précédée d’une détersion. À ces mesures d’hygiène, il convient d’ajouter les autres nombreuses mesures (antibioprophylaxie, arrêt du tabac, équilibre glycémique, normothermie, etc.). Les recommandations nationales sont rédigées selon une méthodologie et une analyse de la littérature aussi rigoureuses que celles du guide de l’OMS. Dès lors, pourquoi « changer une équipe qui gagne » ?