On définit habituellement la multirésistance bactérienne comme une résistance à la majorité des antibiotiques d’utilisation courante en raison de résistances acquises à la majorité de ceux disponibles [1]. Depuis la découverte de la pénicilline il y a 80 ans, chaque mise à disposition d’un nouvel antibiotique a systématiquement été suivie de l’apparition de résistances. Jusqu’à présent, le concept de multirésistance était dynamique puisque les résistances nouvellement acquises étant compensées par le développement de nouveaux antibiotiques. Avec la diminution du nombre de nouvelles molécules disponibles, cet équilibre est rompu et l’émergence de bactéries pan- ou toto-résistantes est devenue une réalité, nécessitant le recours à des traitements antibiotiques de moindre efficacité, plus toxiques, voire menant à des impasses thérapeutiques avec un retour à « l’ère pré antibiotique » [2]. La maîtrise de la diffusion des bactéries multirésistantes (BMR) s’appuie classiquement sur les précautions complémentaires contact (PCC), en plus des précautions standard (PS). De nombreux travaux ces cinq dernières années ont remis en question l’utilité de cette politique. Cet article a pour objet de faire le point sur les stratégies de maîtrise des BMR. Il n’abordera pas les stratégies de maîtrise des bactéries hautement résistantes émergentes (BHRe) : entérobactéries productrices de carbapénémases (EPC), entérocoques résistant aux glycopeptides ou à la vancomycine (ERG ou ERV), ni la gestion des bacilles Gram négatif (BGN) saprophytes, multi- ou toto-résistants comme les Acinetobacter baumannii résistants à l’imipénème (Abri) ou les Pseudomonas aeruginosa producteurs de carbapénèmases.
Situation épidémiologique en 2020
Les principales BMR responsables d’infections associées aux soins (IAS) en 2020 sont les Staphylococcus aureus résistants à la méticilline (SARM) et les entérobactéries productrices de bêtalactamases à spectre étendu (EBLSE). Ces deux bactéries sont commensales du tube digestif (EBLSE) ou du nez et de la peau (SARM), expliquant une durée de portage prolongé qui accroît le risque de transmission croisée entre patients, à la différence des BGN saprophytes. Ces deux BMR ont émergé au début des années 1970 (SARM) et 1990 (EBLSE). Elles sont devenues largement épidémiques dans les hôpitaux français mais avec une évolution secondairement divergente : réduction du SARM depuis le début des années 2000, parallèlement à une augmentation rapide des EBLSE.
Au début des années 1990, la France avait des taux de SARM parmi les plus élevés en Europe [3]. L’application pendant une décennie d’une politique de dépistage et de PCC s’est accompagnée d’une réduction relative, mais c’est la généralisation des solutions hydroalcooliques au début des années 2000 qui semble avoir été l’élément déterminant de leur maîtrise [4]. Ainsi, la part des infections à SARM parmi les infections à S. aureus est passée de 64% en 2001 à 28% en 2017 dans les enquêtes nationales de prévalence. Une réduction du même ordre de grandeur a été observée dans les pays ayant mis en place une politique volontariste de promotion de l’hygiène des mains avec l’utilisation des solution hydroalcoolique (SHA). L’autre élément important de l’épidémiologie du SARM est qu’il s’agit d’une bactérie quasiment exclusivement hospitalière en France, alors que d’autres pays, par exemple les États-Unis, sont concernés par des souches de SARM communautaires. Ainsi, une politique hospitalière de maîtrise des SARM peut permettre leur contrôle, qui sera plus difficile dans les situations où il existe une circulation de souches communautaires (notion de pression de colonisation).
Au début des années 1990, la situation des EBLSE était univoque. Il s’agissait essentiellement de souches de Klebsiella pneumoniae, porteuses de gènes plasmidiques codant principalement pour deux familles d’enzymes, SHV et TEM. Ces souches circulaient principalement dans les services de réanimation où quelques clones diffusaient de façon épidémique. La mise en place de mesures d’hygiène ciblées en réanimation, basées sur un dépistage des porteurs et des PCC, a permis de contrôler cette épidémie [5].
À cette épidémiologie purement hospitalière des EBLSE est venue se superposer au début des années 2000 une épidémiologie communautaire. À l’heure actuelle, les EBLSE sont trouvées chez toutes les espèces d’entérobactéries, principalement chez Escherichia coli, avec une résistance médiée par des enzymes de type CTX-M. La prévalence des E. coli BLSE dans la population générale est de l’ordre de 5 à 10% dans les pays d’Europe de l’Ouest [6,7] et beaucoup plus élevée dans les pays du Sud [8]. Ces souches communautaires de E. coli CTX-M participent à l’épidémie hospitalière, à laquelle s’ajoute une diffusion d’entérobactéries hospitalières comme K. pneumoniae et Enterobacter spp.
Les données de surveillance européenne montrent que la résistance aux céphalosporines de troisième génération (C3G), chez les souches d’E. coli responsables de bactériémies est passée en France de 2% en 2002 à environ 10% en 2016, et jusqu’à 30% chez K. pneumoniae [9]. Chez K. pneumoniae, cette prévalence élevée ne rend compte quasiment que d’infections strictement nosocomiales, à la différence d’E. coli, dont le dénominateur comprend aussi des souches impliquées dans des infections communautaires. Même si les taux d’E. coli et K. pneumoniae résistantes aux C3G sont stabilisés depuis quelques années et même diminuent en 2017 et 2018 pour les E. coli BLSE [10], cette évolution rapide fait des EBLSE un des enjeux majeurs de santé publique pour les prochaines années. Elle est aussi inquiétante, parce qu’elle se produit alors que les mesures de prévention qui avaient permis de contrôler les premières épidémies de BLSE et de SARM sont toujours en place, et que la généralisation des SHA aurait dû en avoir amélioré l’efficacité.
Cette évolution divergente entre SARM et EBLSE est mal comprise mais peut éclairer la discussion sur le choix des mesures de contrôle. Les raisons de cette divergence sont multiples : E. coli est une bactérie commensale, présente en forte concentration dans la flore digestive du sujet sain et bien adaptée à cet écosystème, alors que le SARM est présent dans les réservoirs nasaux et cutanés, en moins grande concentration, donc avec moins d’opportunités de transmission croisée entre patients. Il est possible aussi, mais non démontré à ce jour, que la transmission des EBLSE puisse survenir à partir des excreta manipulés, selles et urines colonisées, alors que ce n’est pas le cas pour le SARM. La dissémination communautaire des EBLSE échappe aux stratégies de contrôle mises en place à l’hôpital, et la prévalence des cas importés de BLSE dans les hôpitaux européens est de l’ordre de 10% en court séjour [7], et plus élevée dans les unités à risque, soins de suite et de réadaptation (SSR) ou réanimation [11]. Les SARM, tout au moins en France, restent des bactéries principalement hospitalières. En revanche, il est maintenant démontré que la diffusion hospitalière des souches d’E. coli BLSE est moins fréquente que celle des autres BLSE hospitalières comme K. pneumoniae ou Enterobacter spp. sans que les raisons en soient comprises [12].
Mesures de contrôle
Historiquement, les mesures de contrôle de la dissémination des BMR ont fait appel à une stratégie dite « verticale », c’est-à-dire reposant sur une politique de dépistage des patients porteurs, et la mise en place de PCC [13,14]. Plus récemment, un certain nombre de publications ont suggéré l’intérêt d’une approche « horizontale », c’est-à-dire le renforcement des PS, appliquées à l’ensemble des patients, qu’ils soient porteurs ou non [15]. L’arrêt des PCC au profit du respect strict des PS ne semblait pas s’accompagner d’une augmentation des taux de BMR, qu’il s’agît des SARM, des ERG ou des EBLSE [15]. La littérature récente suggère d’avoir une attitude nuancée [16,17,18,19]. Les PCC comprennent stricto sensu le port d’équipements de protection individuelle, gants et surblouse ou tablier. On y associe très généralement le placement en chambre individuelle avec toilettes dédiées, et une signalisation du statut BMR du patient dans son dossier et sur la porte de la chambre.
Données de la littérature
Jusqu’il y a une dizaine d’années, quasiment toutes les études ayant évalué l’efficacité des PCC et des PS étaient des études avant/après, quasi expérimentales, dont on sait qu’elles étaient grevées de biais épidémiologiques : mise en œuvre d’autres mesures non prises en compte en parallèle, intervention lancée lors d’une épidémie avec le possible effet de la « régression à la moyenne », absence de mesure de l’observance des mesures recommandées [20]. Plus récemment, plusieurs études ont utilisé une méthodologie robuste (études randomisées par grappes). À noter qu’ici ne seront pas détaillés les travaux s’intéressant à la décontamination cutanée (SARM et ERV) ou nasale (SARM).
Deux études publiées simultanément en 2011 ont évalué une stratégie verticale : dépistage et mise en place de PCC pour les patients identifiés comme porteurs. L’une était une étude randomisée par grappes dans 14 services de réanimation [21], l’autre une étude quasi expérimentale dans les 150 hôpitaux des vétérans américains [22]. La première n’a montré aucun impact de la politique de dépistage et PCC, avec des taux d’importation élevés de SARM et d’ERV, et des taux d’acquisition eux aussi élevés et identiques dans les deux bras. Mais l’adhésion aux PCC, port de gants et hygiène des mains, si elle était plus élevée dans le groupe intervention, restait probablement insuffisante pour limiter la transmission [21]. La seconde étude, dans les hôpitaux de vétérans américains, a montré une diminution importante des taux d’infections à SARM, en réanimation dans un premier temps, puis dans l’ensemble des hôpitaux [22]. Les deux travaux présentaient l’un et l’autre des limites méthodologiques, mais l’intervention efficace dans les hôpitaux des vétérans a été conduite en utilisant une approche comportementale, avec la mobilisation d’un référent en charge de mettre en œuvre les mesures dans chaque hôpital et la réalisation d’audits d’observance d’hygiène des mains avec restitution aux équipes de soin. Le contraste entre ces deux études montre le rôle du leadership et de la mobilisation des personnels soignants pour ces interventions, qui peut être aussi essentiel que les mesures techniques elles-mêmes. De façon intéressante, le même réseau d’hôpitaux des vétérans a montré que ces mesures, qui visaient initialement la maîtrise du SARM, avaient également permis la réduction des taux d’acquisition des bacilles à Gram négatif multirésistants, soulignant là aussi l’importance des stratégies comportementales pour le contrôle de la résistance bactérienne, au-delà des simples mesures techniques [23].
L’étude européenne Mosar visait à évaluer l’efficacité d’une intervention de type horizontal dans un premier temps, puis vertical dans 14 services de réanimation pour le contrôle des BMR : SARM, bacilles Gram négatif multirésistants (essentiellement des EBLSE) et ERV [11]. Après une phase d’observation sans intervention, une première stratégie était appliquée, comportant une amélioration de l’observance de l’hygiène des mains et des toilettes systématiques quotidiennes à la chlorhexidine (stratégie horizontale). Dans un second temps, les mesures universelles étaient poursuivies, auxquelles était ajouté un dépistage à l’admission puis régulier, dont les résultats étaient rendus au service de réanimation pour la mise en place des PCC (stratégie verticale). Les principaux résultats étaient une réduction des taux d’acquisition de SARM, grâce à la stratégie horizontale, sans que la stratégie verticale permette d’augmenter la réduction des acquisitions. Il n’y avait aucun effet sur les ERV, mais leur fréquence était trop faible pour montrer une différence, et aucun effet sur les EBLSE, que ce soit dans une stratégie horizontale ou verticale, alors que la transmission des EBLSE était trois fois plus élevée que celle des SARM et des ERV. L’observance de l’hygiène des mains avait augmenté jusqu’à près de 80% dans la période horizontale et s’était maintenue dans la période verticale. À partir de cette étude, une stratégie horizontale bien menée a permis de contrôler les SARM mais pas les EBLSE, tout au moins avec les taux d’observance observés (mais l’on peut craindre que ces taux élevés d’observance aient été surévalués, comme le sont toutes les données d’audit par effet Hawthorne).
Les mesures verticales (dépistage et PCC) n’apportaient pas de bénéfice au contrôle du SARM.
Une étude randomisée par grappes a été menée dans 20 services de réanimation pour tester l’efficacité du port systématique de gants et de surblouses pour réduire les acquisitions de SARM et d’ERV [24]. La réduction combinée des SARM et des ERV n’était pas significative entre le bras intervention et le bras contrôle. En revanche, la réduction isolée des acquisitions de SARM était significative. Certains critères de jugement secondaires étaient importants dans cette étude : une réduction significative du nombre d’entrées dans les chambres des patients en PCC, mais aussi l’absence d’augmentation significative des effets indésirables dans ce bras, alors que l’hygiène des mains était améliorée dans le groupe avec port universel de gants et de surblouses.
Alors que les études américaines se sont essentiellement intéressées au SARM et aux ERV, plusieurs études récentes européennes ont évalué l’efficacité des mesures vis-à-vis des EBLSE, peut-être parce que les taux de SARM sont en diminution dans de nombreux pays européens, alors que les EBLSE sont ressentis comme un enjeu de santé publique.
Une première étude [25] a été menée dans quatre unités d’hématologie ou de cancérologie où le taux d’acquisition des entérobactéries résistances aux fluoroquinolones aux C3G a été évalué : deux unités plaçaient les patients porteurs en précautions contact et chambre seule, pas les deux autres et, malheureusement sans randomisation entre les sites, ni période d’observation préliminaire [25]. Sur un nombre de 1 400 à 1 500 patients inclus en 12 mois, le taux d’acquisition n’était pas différent entre les deux groupes.
Récemment, une étude randomisée par grappes dans 16 hôpitaux néerlandais a évalué l’impact de placer les patients porteurs d’EBLSE avec PCC soit en chambre individuelle, soit en chambre double [26]. Elle montrait que le placement en chambre multiple n’était pas moins efficace par rapport aux PCC mises en place en chambre seule. Une étude dans quatre pays européens a randomisé par grappes 20 unités de soins de médecine ou de chirurgie entre une période de 12 mois avec PS et de 12 mois avec PCC [7]. Les patients étaient dépistés à l’admission, puis une fois par semaine et à la sortie. Sur plus de 15 000 patients hospitalisés plus de 7 jours, la prévalence de EBLSE à l’admission était de l’ordre de 10% dans chaque groupe, l’incidence d’acquisition de BLSE de 4,6/1 000 jours d’exposition dans chaque groupe, avec une observance d’hygiène des mains de 61% et 62%. Il n’y avait donc pas de différence en faveur des PCC dans cette étude, mais si le taux d’acquisition de E. coli BLSE était identique dans les deux groupes, celui des K. pneumoniae BLSE était plus élevé, bien que non significativement, dans le groupe des patients placés en PS. La même observation avait été faite dans l’étude précédente avec un risque d’acquisition de K. pneumoniae BLSE trois fois plus élevé pour les patients placés en chambre multiple.
Les deux études récentes suggèrent que la chambre individuelle et les PCC sont utiles pour maîtriser la diffusion des EBLSE autres qu’E. coli. Une modélisation à partir des données de l’étude Mosar montrait d’ailleurs aussi que le risque de transmission des entérobactéries BLSE autre qu’E. coli était 3,7 fois plus élevé que celui des E. coli BLSE en réanimation [12]. Enfin, le risque d’infection à K. pneumoniae BLSE chez un porteur était statistiquement plus élevé (13,8%) que celui d’E. coli BLSE chez un porteur de cette BMR (7,8%), dans un grand hôpital universitaire en deux ans (Denkel MA et al. Clin Microb Infect 2020, in press).
Un élément important de la stratégie de maîtrise des EBLSE est donc la différence de transmissibilité entre E. coli BLSE et les autres entérobactéries BLSE, démontrée dans maintenant trois études contrôlées de haut niveau méthodologique, ainsi qu’un surrisque d’infection à EBLSE chez un porteur K. pneumoniae BLSE, là aussi avec une méthodologie optimale.
Écueils et obstacles à la mise en œuvre des précautions complémentaires contact
Port des gants
Le port de gants dans le cadre des PCC a fait l’objet de débats : il n’est plus recommandé en France depuis 2009 et quelques autres pays l’ont aussi supprimé [13]. En effet, le port de gants se substitue parfois à l’hygiène des mains, notamment en entrant dans la chambre. Les gants sont souvent utilisés en excès, au-delà du risque d’exposition aux liquides biologiques. D’autres travaux montrent qu’ils sont également mal utilisés, notamment dans les enchaînements de soins où la même paire est souvent utilisée pour plusieurs gestes de soins successifs à risque infectieux différent.
Hygiène des mains
La plupart des études montrent que l’observance de l’hygiène des mains augmente quand le patient est placé en PCC [24]. Cependant, avec l’introduction des SHA depuis le début des années 2000, l’observance de l’hygiène des mains a été nettement améliorée, qui rapproche l’efficacité des PS de celle des PCC. On peut donc concevoir qu’une très bonne observance de l’hygiène des mains soit suffisante pour maîtriser la circulation des BMR.
Identification des réservoirs porteurs
En l’absence de politique de dépistage à l’admission, s’appuyer sur les seuls prélèvements cliniques ne permet de connaître qu’une faible proportion des porteurs. Par exemple pour les EBLSE, seuls 16% des porteurs en réanimation développaient au moins une infection au cours de leur séjour [27]. Cette proportion est de 7,8% et 13,8% selon la BLSE dans l’étude citée plus haut. Dans une enquête de prévalence dans deux hôpitaux de court séjour et SSR, la prévalence du portage d’EBLSE était de 17%, similaire quelle que soit la spécialité ; seulement 34% des patients étaient connus porteurs de BLSE, dont 20% à partir d’un prélèvement clinique et 14% par un dépistage ciblé dans les services à haut risque [28]. On peut donc s’interroger sur l’utilité de placer en PCC une faible proportion des patients porteurs infectés, négligeant la majorité des patients porteurs non infectés, sauf à avoir une politique de dépistage extensive à l’admission hospitalière.
Chambre individuelle
Dans une étude quasi expérimentale suisse, le taux de transmission à partir de patients porteurs d’EBLSE vers les patients de la même chambre était faible à 1,5% [29] ; le taux d’acquisition d’E. coli BLSE est resté faible dans les 18 mois qui ont suivi l’arrêt des PCC pour les porteurs d’E. coli BLSE, ceci dans un hôpital avec une observance élevée des PS et de l’hygiène des mains [30]. L’étude néerlandaise citée plus haut montrait que les PCC appliquées en chambre double ne s’accompagnaient pas d’un taux d’acquisition de BLSE plus élevé que PCC en chambre individuelle, sauf une tendance pour K. pneumoniae au bénéfice de la chambre individuelle [26]. Même si la France est un des pays d’Europe qui dispose de la plus grande proportion de chambres individuelles, le placement en chambre individuelle pose des problèmes organisationnels dans les services quand leur nombre est insuffisant.
Recommandations en cours
Les recommandations françaises et américaines de contrôle des BMR préconisent un dépistage ciblé dans les services à risque et la mise en place des PCC [13,31,32]. La european society of clinical microbiology and infectious diseases (Escmid) a publié en 2013 des recommandations plus nuancées : en situation épidémique, il est fortement recommandé, sur la base d’une évidence scientifique modérée, de placer les patients en chambre seule, PCC avec un contrôle de l’environnement ; en revanche, en situation endémique, la recommandation de placer les porteurs d’E. coli BLSE en PCC et chambre seule n’est plus que conditionnelle [16].
Critères de choix
Aux termes de cette analyse, plusieurs points d’ordre épidémiologique ressortent :
- le contrôle des SARM est plus facile que celui des EBLSE, tout au moins nécessite une observance d’hygiène des mains moins élevée que pour les EBLSE ;
- l’arrêt des PCC ne semble pas s’accompagner d’une augmentation des taux de BMR, qu’il s’agisse des SARM, des ERG ou des EBLSE, sous réserve d’un respect strict des PS [15], mais toutes ces études sont de type quasi expérimentales ;
- la part importée des E. coli BLSE de la communauté participe à la pression de colonisation dans les hôpitaux, et ne peut pas être contrôlée par les mesures hospitalières ;
- il existe maintenant des arguments solides et dans des populations de patients et des pays différents en faveur d’une politique différenciée entre E. coli BLSE et les autres entérobactéries BLSE [19] ;
- le contrôle des BMR doit s’intégrer dans une politique plus large de contrôle de la transmission des agents infectieux, comprenant le contrôle des BHRe, celui des BGN saprophytes résistants dans les services à risque, et une amélioration de l’observance de l’hygiène des mains dans l’ensemble des situations de soin.
Ces éléments et d’autres ci-dessous et listés dans le tableau doivent donc être pris en compte pour définir une politique de maîtrise de la multirésistance.
Il est important de prendre en compte les BMR ou BHRe et leurs épidémies locales, régionales et nationales. Ainsi, la politique nationale de maîtrise de la dissémination des BHRe (EPC et ERV) doit être privilégiée [33]. Pour ces deux BHRe, la situation reste encore émergente en France, et des mesures de contrôle strictes, associant PCC, dépistage extensif des patients à risque et des contacts des porteurs sont efficaces pour empêcher leur dissémination. Plusieurs pays ont montré l’efficacité d’une politique stricte de contrôle, qu’il s’agisse des EPC en Israël [34], des EPC et des ERV en France [35] et des SARM dans les pays d’Europe du Nord [36]. De plus, les modélisations mathématiques montrent que le bénéfice obtenu par l’adhésion de la majorité des établissements de santé à une politique stricte peut être perdu à cause d’un petit nombre d’établissements n’appliquant pas les recommandations [37].
Un deuxième élément est que l’observance de l’hygiène des mains dans le cadre des PS ou des PCC est en réalité plus faible que les taux rapportés par des audits, dont on sait qu’ils augmentent notablement les taux d’observance par effet Hawthorne [38]. Il est donc nécessaire de s’appuyer sur la consommation des SHA en plus des audits de pratiques. Dans les unités de soin ou les hôpitaux où l’observance et la consommation de SHA sont très faibles, par exemple inférieures à 30% ou 40%, le premier objectif est de l’améliorer avant d’envisager de mettre en place des PCC [39]. En revanche, dans les unités où l’observance de l’hygiène des mains est élevée, l’impact des PCC sera plus faible.
La mise en place des PCC doit être idéalement associée au placement en chambre individuelle. Cependant, quand leur nombre est insuffisant, il est nécessaire de sélectionner les patients ou les BMR qui peuvent en bénéficier.
Il est aussi montré que plus le nombre de patients à placer en PCC est élevé, moins bonne est l’observance pour chacun des patients en PCC [40]. Il y a donc un équilibre à trouver entre les patients placés en PS bien respectées et les patients placés en PCC.
Ainsi, une analyse de risque doit être menée par les équipes opérationnelles d’hygiène (EOH) dans chaque hôpital, en fonction de leurs épidémiologies locales et régionales, tout en restant dans le cadre des recommandations nationales, notamment celles pour les BHRe. La Société française d’hygiène hospitalière (SF2H) avait proposé des éléments pour aider à cette analyse de risque [41]. Le tableau I ci-dessous en propose une analyse proche.
Au-delà des mesures techniques, plusieurs travaux ont bien montré que la façon de mettre les mesures de précaution en place, le leadership, le management, étaient déterminants pour l’adhésion des équipes de soin à l’une ou l’autre des stratégies [42]. Vu d’une EOH, il est aisé de déterminer les équipes de soin (et leur encadrement médical et paramédical) mobilisées pour la prévention des IAS et l’hygiène des mains, et celle dont la mobilisation est absente ou insuffisante.
L’impact des PCC sur la survenue d’évènements indésirables et sur les éléments d’anxiété et de dépression des patients placés en PCC est discuté. Des premiers travaux avaient suggéré que le placement en PCC s’accompagnait d’une plus grande fréquence d’évènements indésirables, d’une surveillance moins attentive et d’une perception par les patients d’une moindre attention [43,44]. D’autres ont donné des résultats inverses [24]. Les éléments d’anxiété et de dépression sont plus liés à l’état préexistant du patient avant le placement en PCC qu’à l’hospitalisation elle-même [45,46]. Cependant les soins sont généralement réorganisés pour les patients placés en PCC avec des entrées dans la chambre moins fréquentes pour réaliser des soins regroupés [24].
Deux sujets n’ont pas été abordés spécifiquement dans cette revue : le contrôle de la contamination environnementale et la gestion des excreta. Il existe des arguments de plus en plus solides, illustrés par les EPC, pour montrer que l’environnement humide peut constituer un réservoir de bactéries multirésistantes [47]. De la même façon, on sait que les Staphylococcus aureus et plus encore les ERV et les Acinetobacter baumannii ont une capacité de survie prolongée dans l’environnement. Il est donc nécessaire d’assurer un entretien de l’environnement autour du patient et de prendre en compte le risque d’y contaminer ses mains, en considérant que ce sont des indications à l’hygiène des mains, au même titre que le contact direct avec le patient.
C’est une particularité française de parler depuis une dizaine d’années du risque de transmission des entérobactéries BLSE ou EPC à partir des excreta et notamment des selles. Il est logique de penser que la manipulation des excreta est un facteur de risque de contamination des mains et de transmission croisée. Cependant, les arguments en faveur d’un risque lié aux excreta dans les hôpitaux ne sont pas pour l’instant établis. Il est cependant nécessaire de regarder la façon dont sont gérés les excreta pour s’assurer qu’ils ne représentent pas une possibilité de transmission croisée entre patients.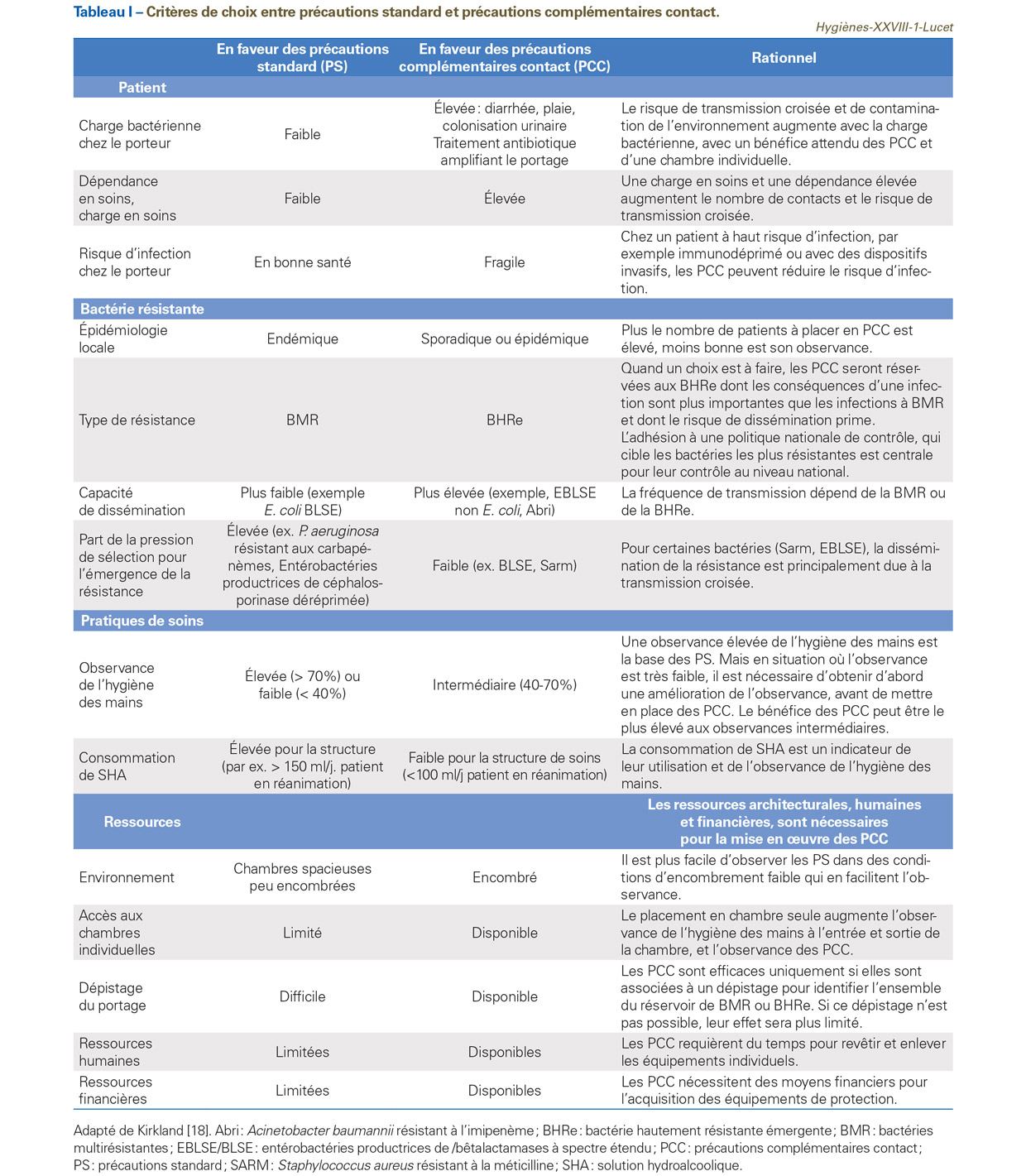
Conclusion
Les données scientifiques s’accumulent pour indiquer que les précautions standard sont suffisantes dans un certain nombre de situations, en particulier pour les E. coli BLSE. Mais des conditions doivent être remplies pour placer les patients porteurs de BMR en PS, en particulier un bon niveau d’observance d’hygiène des mains et une consommation de SHA témoignant de leur bonne utilisation. Si la stabilisation des entérobactéries BLSE non Escherichia coli est un élément d’optimisme, il n’en reste pas moins que les Klebsiella pneumoniae et Enterobacter continuent à circuler dans nos hôpitaux, pour lesquels une politique stricte des PCC doit probablement être appliquée comme le suggèrent les études récentes. Quelle que soit la BLSE considérée, il est essentiel de mettre l’accent sur les PS et sur l’augmentation de l’utilisation des SHA dans les établissements de santé français, en s’appuyant sur les outils disponibles, audits d’observance et indicateur de consommation des solutions hydroalcooliques (Icsha). Puisque le contrôle des SARM paraît plus facile que celui des EBLSE, on peut penser que les PS pourraient suffire aussi pour les porteurs de SARM, mais les études sont généralement quasi expérimentales, avec leurs limites. Deux études randomisées contrôlées ont donné des résultats positifs avec une amélioration de l’observance de l’hygiène des mains, mais l’une était associée à des toilettes antiseptiques et l’autre au port universel de gants et de tabliers. En revanche, la situation épidémiologique des BHRe, EPC et ERV, justifie la poursuite d’une politique stricte de dépistage et de PCC pour ces patients.