Introduction
L’histoire de la prévention des infections associées aux soins a été marquée par le concept d’antisepsie développé par Lister dans la seconde moitié du XIXe siècle et par le recours, avant un acte invasif, à des produits antiseptiques actifs sur les bactéries responsables de ces infections. Beaucoup moins étudiés que ceux impliqués dans la résistance bactérienne aux antibiotiques, des mécanismes de diminution de sensibilité ou de résistance aux antiseptiques sont actuellement décrits, quelquefois partagés avec les premiers. L’objectif de ce document est de faire le point sur cette problématique, qui a été abordée lors d’une webconférence organisée en septembre 2023 par Info ATB-VAC1, avec le soutien du laboratoire Viatris (Canonsburg, PA, États-Unis).
Les antiseptiques, médicaments soumis à un système normatif
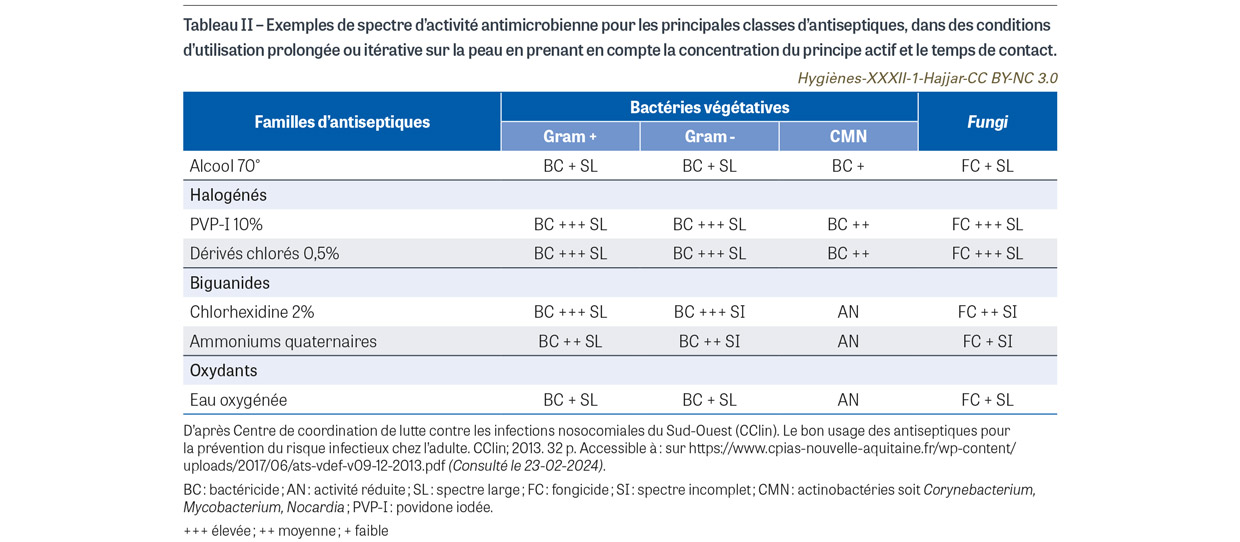
Il importe de rappeler que les antiseptiques en France font partie de la classe des médicaments, qui dépendent d’une autorisation de mise sur le marché (AMM) précisant leurs indications et contre-indications. Ils sont soumis à des normes dont l’objectif est de comparer, in vitro selon une méthode standardisée, leurs performances en termes d’activité bactéricide et fongicide (Tableau I). Si pour l’efficacité in vitro il est attendu une réduction de 5 log10 d’un inoculum en suspension, l’efficacité in vivo est peu ou non évaluée faute de méthode normalisée, et peut être modifiée lors de l’application cutanée comme le montre l’étude ancienne de Messager et al. [1]. L’alcool, les ammoniums quaternaires, les biguanides (chlorhexidine), les halogénés (dérivés chlorés, povidone iodée) et les oxydants constituent les principales familles d’antiseptiques. Les antiseptiques utilisés en pratique clinique sont qualifiés de « majeurs » (définition non consensuelle) quand ils présentent une activité bactéricide, un large spectre et une action rapide. C’est le cas de la chlorhexidine, gamme disponible en solution alcoolique (concentration supérieure ou égale à 0,5%) et en scrub pour la détersion, de la povidone iodée, gamme disponible en solution aqueuse et en solution alcoolique, ainsi qu’en scrub pour la détersion, des dérivés chlorés, disponibles en solution aqueuse, et de l’éthanol à 60% ou à 70%. Schématiquement, les ammoniums quaternaires et les biguanides (principes actifs de grande taille) ont pour site d’action la membrane bactérienne ; mais cette membrane joue un rôle protecteur pour les bactéries à Gram négatif sous leur forme végétative, pour toutes les bactéries sous leur forme sporulée, et pour les mycobactéries. Les dérivés chlorés et iodés (principes actifs de petite taille) ont pour site d’action le cytoplasme bactérien qui laisse pénétrer l’antiseptique sans frein, entraînant une oxydation et une coagulation des protéines cytoplasmiques. Ainsi, leur spectre d’activité est la traduction de la résistance naturelle propre à une espèce microbienne. Pour les dérivés halogénés, le spectre d’activité couvre tous les micro-organismes. Ce spectre est plus réduit pour la chlorhexidine, qui est plus active sur les bactéries à Gram positif que sur celles à Gram négatif (Tableau II).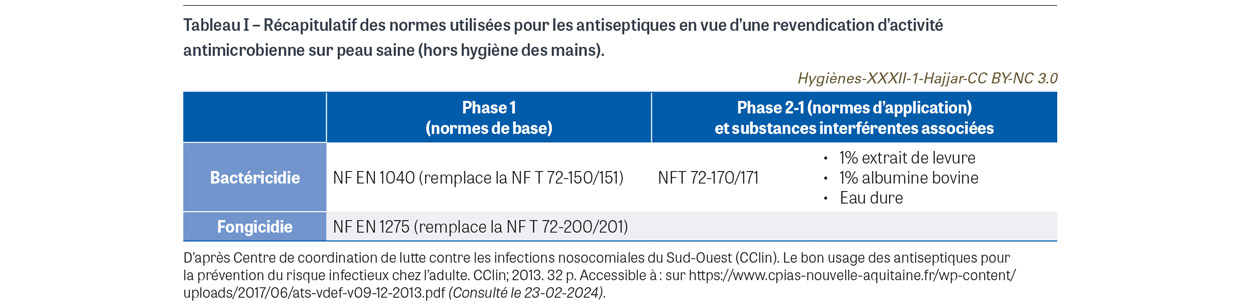
Le microbiote cutané et ses interférences avec les antiseptiques
Alors que la peau est le plus grand organe du corps humain (25-30 m2), le microbiote cutané est constitué d’une biomasse beaucoup plus faible (104/cm2-106 cm2) que celle située au niveau intestinal [2]. L’étude du microbiote cutané (principalement bactérien) peut se faire par méthode culturale (environ 80% des bactéries sont cultivables) ou plus récemment par approche métagénomique basée sur le séquençage à haut débit (next-generation sequencing [NGS]) [2,3]. Une très grande diversité de micro-environnements liés à différents paramètres (exposition aux ultraviolets [UV], pH, température, humidité, présence de sébum, topographie) et l’influence d’annexes (glandes sudoripares, glandes sébacées et follicules pileux) permettent de distinguer trois types de sites anatomiques : les sites gras ou sébacés (p. ex. front, dos), les sites humides (p. ex. aisselles, plis du coude, plis inguinaux, espaces interorteils) et les sites secs (p. ex. fesses, paumes, avant-bras) [2]. Une grande variabilité interindividuelle du microbiote cutané est associée à une spécificité de celui-ci selon le site anatomique [2] : les sites gras sont à prédominance de micro-organismes lipophiles comme les espèces du genre Cutibacterium, principaux résidents de l’unité pilosébacée ; les sites humides contiennent principalement Staphylococcus spp. et Corynebacterium spp ; les sites secs montrent une diversité plus importante avec une abondance de bactéries à Gram négatif suivies des genres Cutibacterium, Micrococcus, Corynebacterium et Staphylococcus. L’évolution du microbiote cutané est marquée par plusieurs facteurs au cours de la vie (notamment le mode d’accouchement, l’imprégnation hormonale à l’adolescence, le vieillissement) alors qu’il est à peu près stable au cours de l’âge adulte [4]. Le microbiote cutané a différentes fonctions physiologiques importantes : maintien de l’homéostasie (p. ex. production d’acides gras libres, de vitamines et d’acides aminés, sécrétion de protéases et d’enzymes, production de peptides antimicrobiens, compétition nutritionnelle…) ; effet de barrière protectrice ; développement et maturation du système immunitaire ; réparation de la peau [5,6]. Le microbiote cutané est aussi associé à diverses maladies : pathologie inflammatoire liée à une dysbiose (p. ex. acné vulgaire, dermatite atopique, psoriasis, rosacée) et des infections opportunistes sur terrains favorisants (immunodépression, plaie, chirurgie) [7]. La peau et son microbiote sont exposés de façon importante aux antiseptiques. Plusieurs études ont été menées au cours des dix dernières années, aux États-Unis et en France, sur l’éventuel effet délétère des antiseptiques sur le microbiote cutané, sa composition et sa richesse. L’effet des antiseptiques semble limité dans l’ensemble de ces études, toutes monocentriques et très différentes d’un point de vue méthodologique (en termes de patients, de sites, de méthodes d’étude du microbiote, d’antiseptiques ou de protocoles d’antisepsie) [8,9,10,11,12,13,14,15] (Tableau III).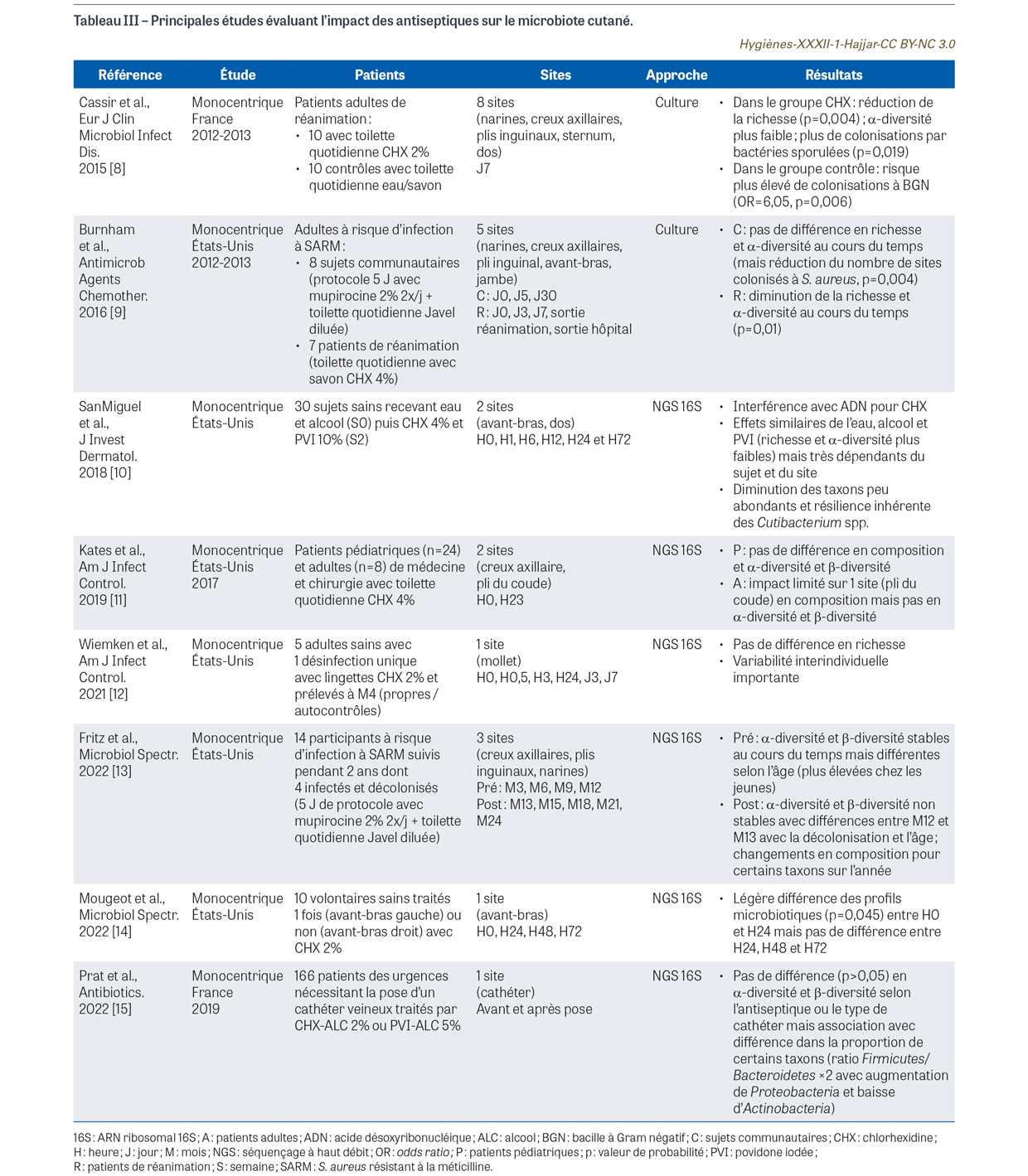
L’utilisation des antiseptiques en pratique clinique pour les gestes invasifs et leurs mésusages
Lors de la pose de cathéter intravasculaire et de la préparation de l’opéré, la réalisation d’une antisepsie de la peau de haute qualité constitue une des mesures essentielles de l’ensemble de mesures pour la prévention des infections associées aux soins telles que les bactériémies liées à un cathéter et les infections du site opératoire. Dans le cadre des missions nationales de Surveillance et prévention des infections associées aux dispositifs invasifs (Spiadi) et de Surveillance et prévention du risque infectieux en chirurgie et médecine interventionnelle (Spicmi), les professionnels des équipes opérationnelles d’hygiène sont encouragés depuis 2020 à observer leurs collègues réalisant la préparation cutanée qui précède la pose d’un cathéter ou une chirurgie, afin de détecter les écarts entre pratiques et recommandations nationales [16,17]. Les données récentes de Spiadi 2020-2023 (protocole Observa4) concernent l’utilisation des antiseptiques pour la pose de cathéter (central et périphérique), la pose d’aiguille sur cathéter à chambre implantée (CCI), la réfection de pansement et les manipulations proximales de ligne de cathéter central ; les données de Spicmi 2021 portent sur la désinfection de la peau saine avant chirurgie.
Utilisation des antiseptiques pour la pose de cathéter chez l’adulte (Spiadi 2020-2023)
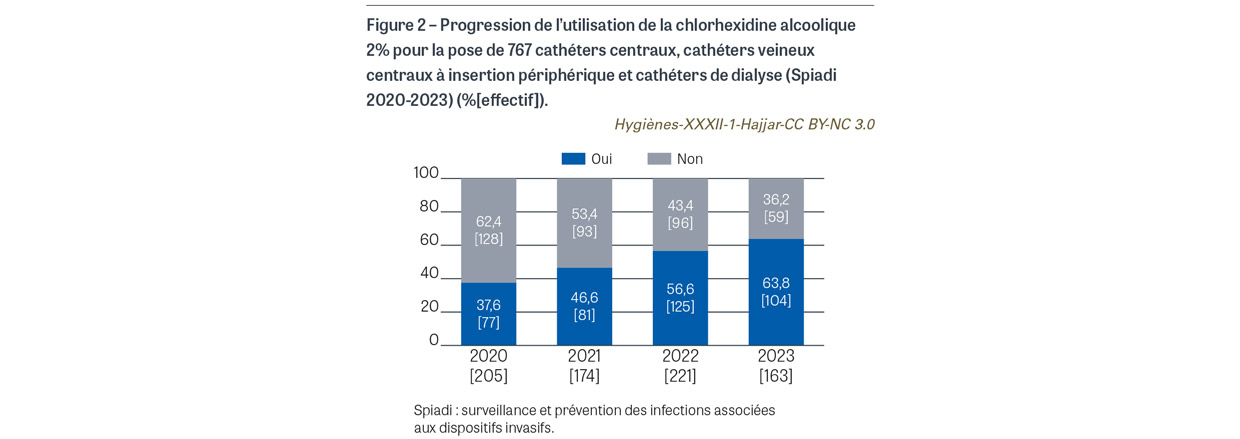
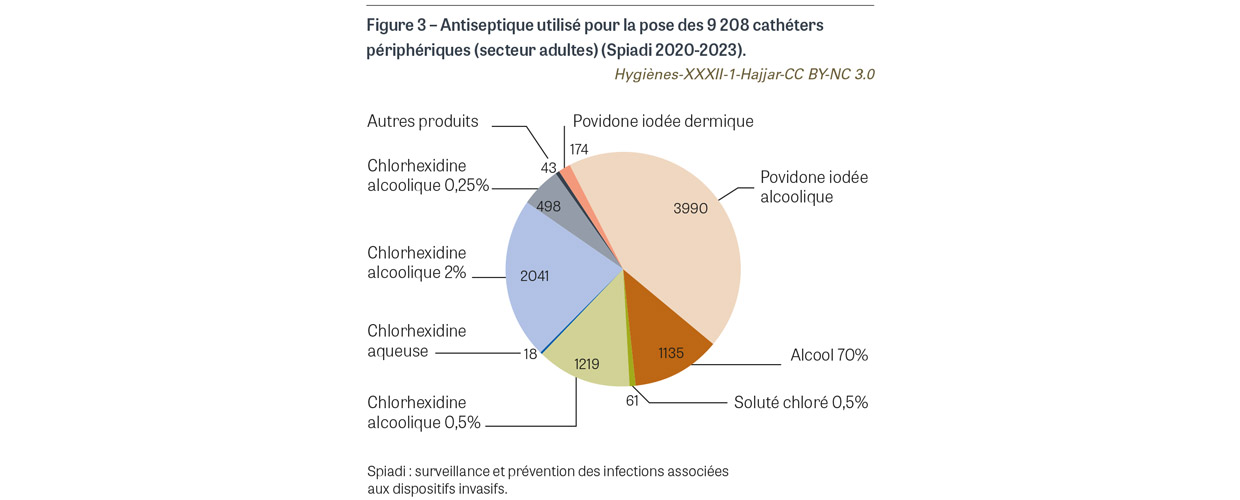
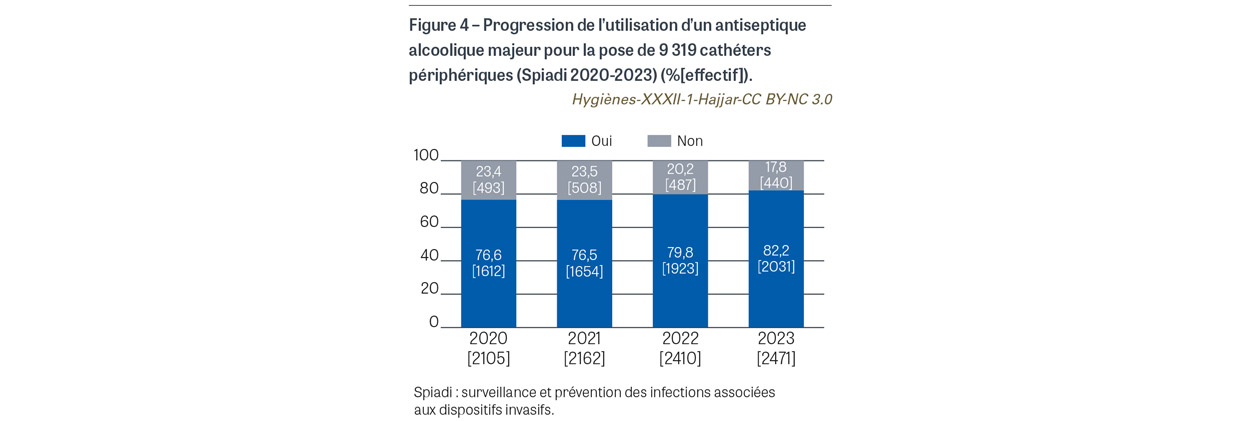
Avant la pose de cathéter veineux central (CVC), de CVC à insertion périphérique (PICC2) et de cathéter de dialyse, il était attendu l’application sur peau propre d’une compresse ou d’un applicateur stérile imprégné de chlorhexidine alcoolique 2%. Pour les 763 poses de cathéter observées, une antisepsie a été observée pour tous les cas. L’antisepsie a été réalisée sur peau propre dans 760 cas (99,6%). Le produit antiseptique a été renseigné pour 759 cas. Pour 738 cas (96,7%), l’antiseptique utilisé est un antiseptique alcoolique majeur (Figure 1). La chlorhexidine alcoolique 2% a été utilisée dans 387 cas (50,7%), avec une progression de l’utilisation de cet antiseptique depuis 2020 (Figure 2). Avant la pose de cathéter périphérique, il était attendu l’application sur peau propre d’une compresse ou d’un applicateur stérile imprégné d’un antiseptique alcoolique majeur. Sur les 9 208 poses de cathéters observées, l’application d’un antiseptique a été observée dans 9179 cas (99,7%). L’antisepsie a été réalisée sur peau propre dans 9 070 cas (98,5%) (Figure 3). Un antiseptique alcoolique majeur été utilisé dans 7 250 cas (78,7%), avec une progression de l’utilisation d’un antiseptique adéquat depuis 2020 (p<0,001) (Figure 4).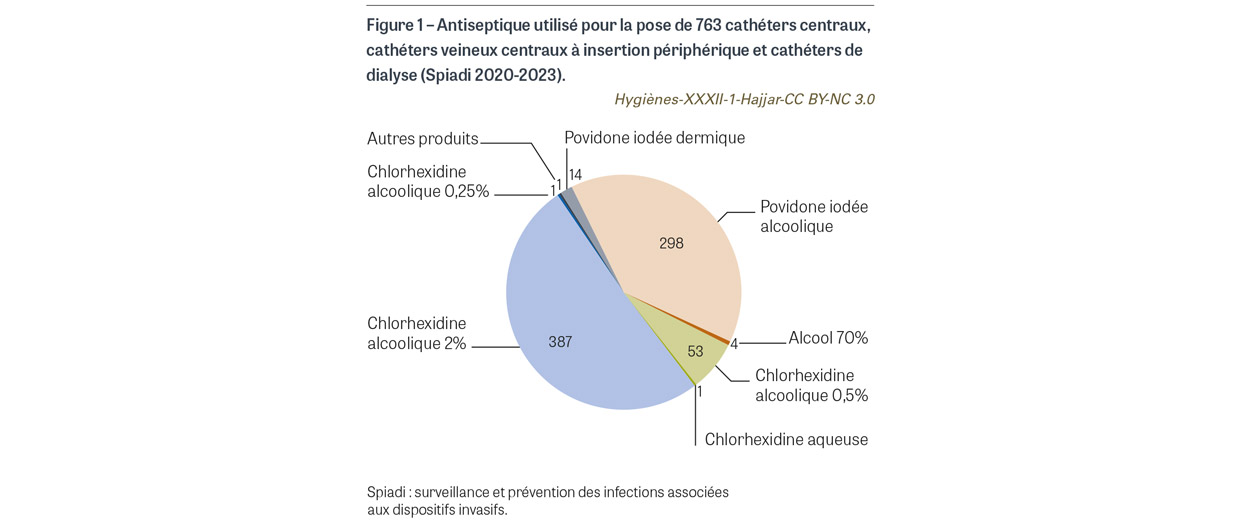
Utilisation des antiseptiques pour la pose d’aiguille sur cathéter à chambre implantée (Spiadi 2020-2023)
Il était attendu une application sur peau propre d’une compresse ou d’un applicateur stérile imprégné d’un antiseptique alcoolique majeur. Pour 2 921 poses d’aiguille observées, l’antisepsie a été réalisée sur peau propre dans 2 886 cas (98,8%). Un antiseptique alcoolique majeur était utilisé dans 2 760 cas (94,5%), avec une progression de l’utilisation de cet antiseptique depuis 2020 (91,0% en 2020 vs 96,7% en 2023 ; p<0,001).
Réfection d’un pansement de cathéter central (Spiadi 2023)
Il était attendu une application sur peau propre d’une compresse ou d’un applicateur stérile imprégné d’un antiseptique alcoolique majeur. Pour 625 réfections de pansement observées, la réfection a débuté par le nettoyage de la peau dans 456 cas (73,0%). Un antiseptique a été appliqué dans 620 cas (99,2%), il s’agissait d’un antiseptique alcoolique majeur dans 569 cas (91,0%).
Manipulations proximales de ligne principale de cathéter central (Spiadi 2020-2023)
Il était attendu une manipulation de la connectique avec une compresse stérile imprégnée d’alcool 70% et, avant d’utiliser une valve, une friction pendant 15 secondes avec une compresse stérile imprégnée d’alcool 70%. Pour 2 898 manipulations observées, la connectique a été manipulée avec des compresses stériles imprégnées d’un antiseptique dans 2 759 cas (95,2%). L’alcool 70% a été utilisé dans 452 cas (15,6%). Une valve a été utilisée dans 892 cas (30,8%), et cette utilisation a été précédée d’une friction de la valve avec une compresse stérile imprégnée d’un antiseptique dans 767 cas (86,0%), avec une gestuelle conforme dans 80% des cas.
Désinfection de la peau saine avant une chirurgie (Spicmi 2021).
Il était attendu une application sur peau propre d’une compresse stérile imprégnée d’un antiseptique alcoolique majeur. Au cours des 2 265 observations, l’antisepsie a été faite sur peau propre dans 2 263 cas (100%). L’antiseptique appliqué a été un antiseptique majeur dans 1 994 cas (88%) : la povidone iodée alcoolique dans 92% des cas, la chlorhexidine alcoolique 0,5% dans 2% des cas et la chlorhexidine alcoolique 2% dans 6% des cas.
Bilan 2023
Au total, en 2023, l’antiseptique utilisé est un antiseptique attendu pour 63,8% des poses de cathéter central, 82,2% des poses de cathéter périphérique, 96,7% des poses d’aiguille sur CCI, et 91,0% des réfections de pansement d’un cathéter central. Les produits inadaptés tels que les antiseptiques non alcooliques sont écartés grâce au travail de terrain des équipes opérationnelles d’hygiène. C’est un résultat très satisfaisant, pour lequel les observations de pratiques continueront de montrer la progression future. Néanmoins, les conditions de l’application de l’antiseptique ne permettent pas toujours de garantir un résultat optimal. L’application de l’antiseptique n’est pas constamment réalisée avec des compresses ou un applicateur stériles, notamment pour la pose d’un cathéter périphérique (Tableau IV). De plus, le temps d’action nécessaire pour l’action antiseptique n’est pas toujours garanti. En effet, selon les données de la mission Spicmi 2021, le respect du temps nécessaire au séchage spontané de l’antiseptique n’est pas observé dans 3,0% des 763 poses de cathéter central, 21,8% des 9 319 poses de cathéter périphérique, 12,3% des 2 921 poses d’aiguille sur CCI, 13,6% des 625 réfections de pansement de cathéter central, et 18,0% des préparations de l’opéré (413/2 257). L’application d’un antiseptique adapté avec un dispositif stérile (compresses ou applicateur) suivie d’un temps de séchage suffisamment long pour permettre l’action antiseptique est essentielle.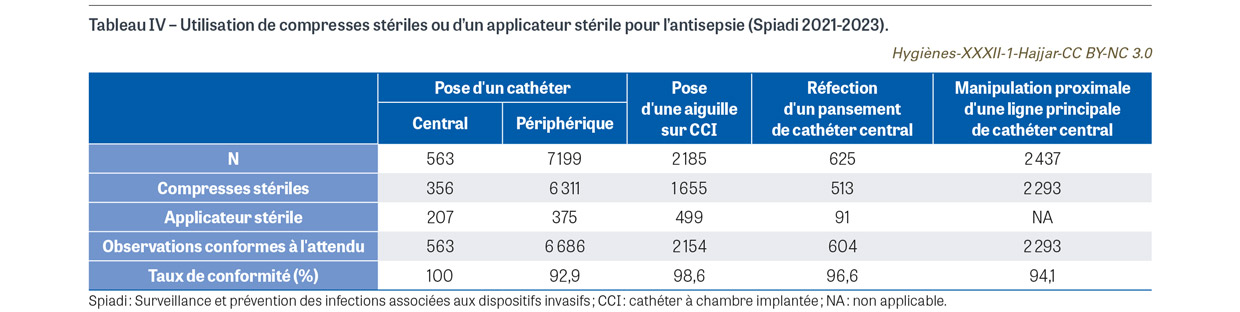
La résistance aux antiseptiques, un mythe ou une réalité
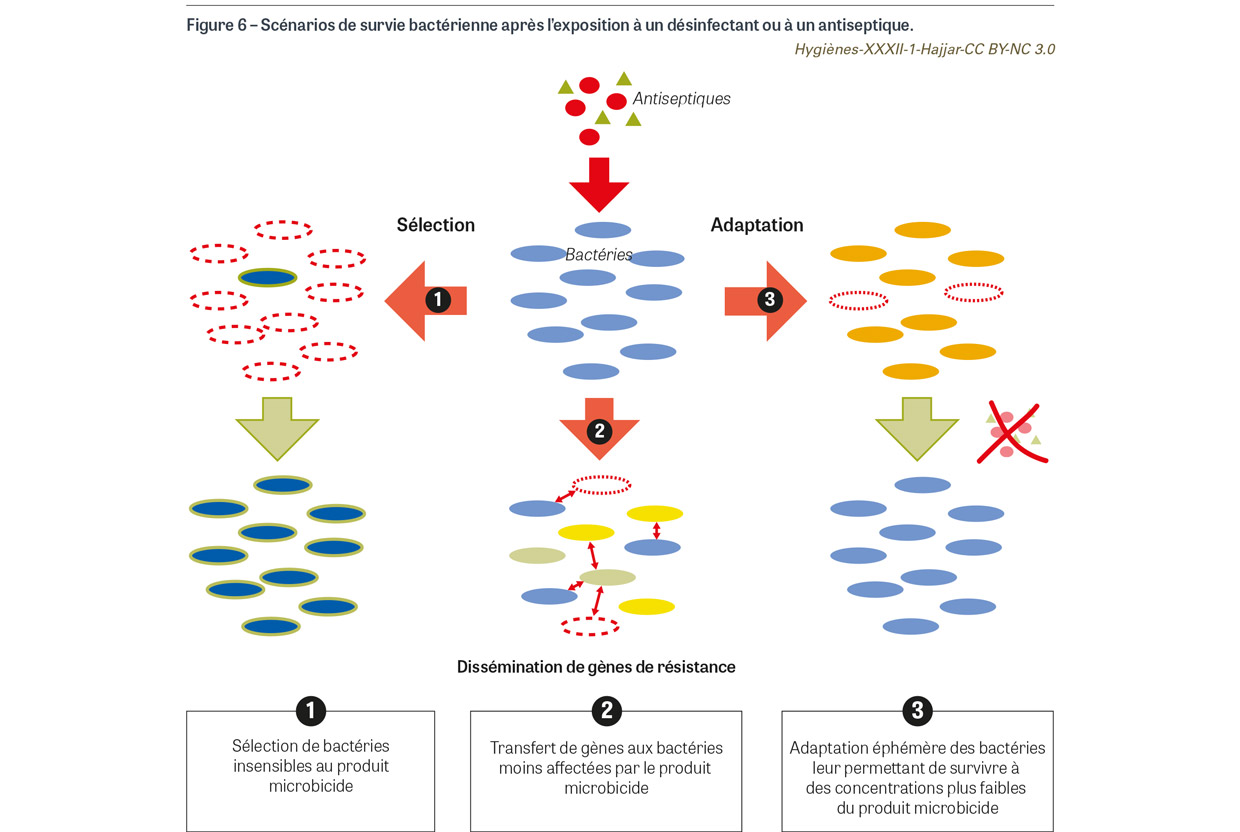
L’efficacité bactéricide des antiseptiques dépend de plusieurs facteurs liés aux micro-organismes, à la concentration du principe actif et à la formulation du produit, mais aussi aux conditions d’utilisation [18,19] (Figure 5). La concentration d’antiseptique à laquelle les bactéries sont exposées est la clé car l’efficacité létale du produit dépend du nombre de cibles bactériennes atteintes et de la sévérité des dommages causés à ces cibles [20]. En tenant compte de l’interaction entre un antiseptique et une population bactérienne, trois scénarios de survie bactérienne peuvent être retenus (Figure 6). Le premier est une sélection des bactéries les moins sensibles à l’effet létal du produit grâce à des mécanismes de résistance intrinsèque ou à des mutations. Le deuxième est l’expression de mécanismes de résistance intrinsèque ou acquise qui permet de décroître la concentration du principe actif à un niveau permettant la croissance bactérienne. Le troisième est la dissémination de gènes de résistance aux bactéries qui survivent au produit. Dans le premier scénario, une population bactérienne avec de nouvelles propriétés émerge et devient dominante ; dans le second, la même population bactérienne réémerge quand les bactéries ne sont plus en contact avec le produit microbicide (Figure 6). La résistance bactérienne aux antiseptiques a été documentée depuis les années 1950 et observée depuis pour tous les principes actifs [19].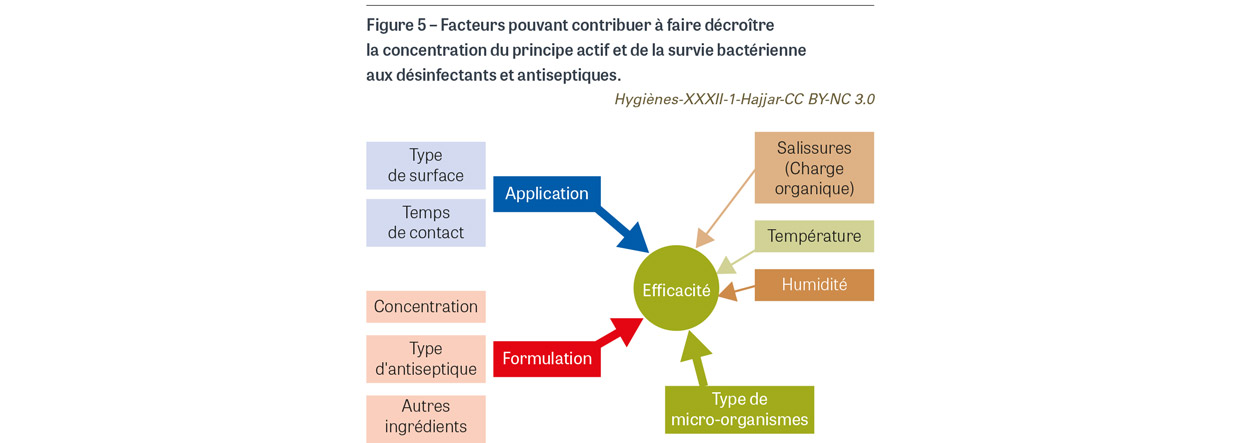
Résistance intrinsèque
La résistance intrinsèque est une propriété innée des bactéries qui présentent des sensibilités différentes aux principes actifs [19]. La structure bactérienne qui est la plus résistante aux antiseptiques est l’endospore, dont la structure est responsable de leur haut niveau de résistance aux produits antimicrobiens [21]. Chez les bactéries dites végétatives, plusieurs mécanismes liés à la résistance intrinsèque ont été décrits [19]. Certains renforcent l’imperméabilité de la bactérie, tels que la présence de lipopolysaccharides dans la membrane externe des bactéries à Gram négatif ou la présence d’acides mycoliques dans le squelette de la paroi des mycobactéries et la présence de lipides dans leur couche externe. D’autres concernent la régulation des porines membranaires régulant le flux de molécules hydrophiles ou la présence de pompes d’efflux [19] (Figure 7). La présence de pigments comme la mélanine ou les caroténoïdes peuvent en principe réagir avec les agents antimicrobiens cationiques ou les oxydants [22]. Les bactéries à Gram positif sont en général plus sensibles aux antiseptiques, bien que des différences d’efficacité de principes actifs puissent être observées au sein d’une même espèce bactérienne, par exemple, la susceptibilité de Staphylococcus aureus aux gels hydro-alcooliques [23].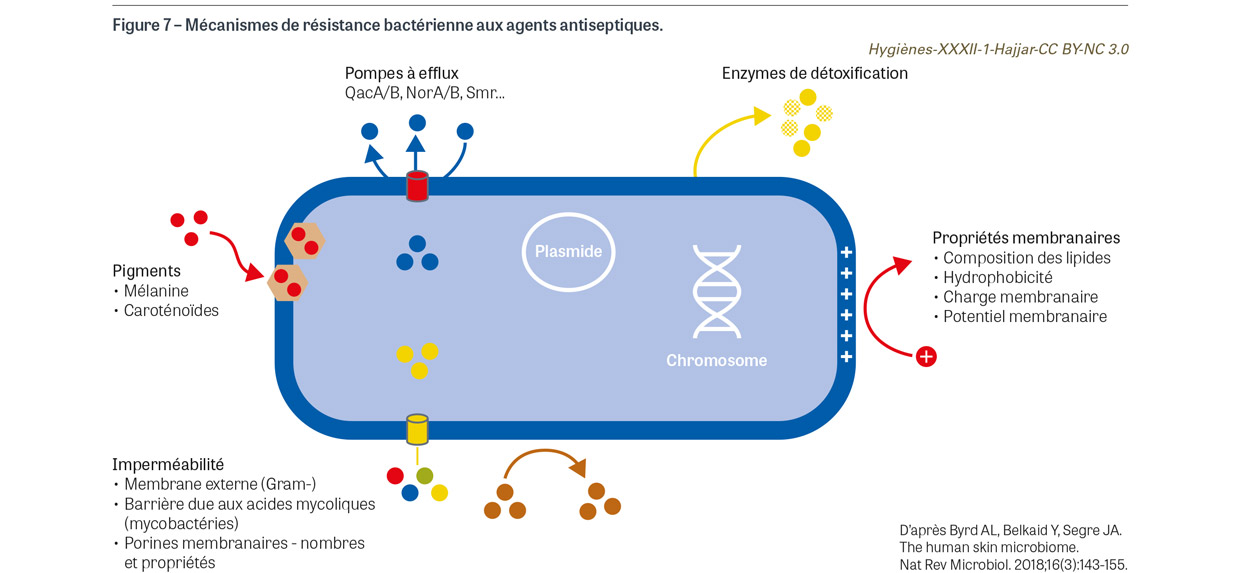
Résistance acquise
La résistance acquise correspond à l’acquisition par la bactérie de nouvelles propriétés par transfert de gènes ou par mutation (Figure 6). L’acquisition de pompes d’efflux est probablement le mécanisme le plus étudié avec le portage, bien documenté, de plusieurs gènes d’efflux par des isolats cliniques [19]. En général, l’expression des pompes d’efflux contribue à réduire la concentration d’un principe actif, mais ne permet pas aux bactéries de survivre dans des concentrations élevées de désinfectant [18]. Est également décrite l’acquisition de nouvelles porines ou d’enzymes de détoxification, notamment aux ions métalliques [18,19]. Les mutations bactériennes résultant d’un phénomène de sélection par un agent antibactérien peuvent affecter des gènes régulateurs globaux qui conduisent, par exemple, à un changement de propriété membranaire ou à une surexpression de pompes d’efflux [19]. Les antiseptiques contribuent à stresser la cellule bactérienne, particulièrement quand la concentration d’exposition n’est plus létale (Figure 5). Les mécanismes de résistance bactérienne acquise ou intrinsèque agissent ensemble pour réduire la concentration nuisible à la cellule et permettent à la bactérie de réparer les dommages causés par le désinfectant [19,24] (Figure 3). De nombreuses études ont observé une modification de l’activité de gènes de régulation comme marS et soxS à la suite d’une exposition de la bactérie à une concentration non létale de principes actifs [25,26]. Souvent les changements d’expression génétiques et phénotypiques sont transitoires et observés seulement en la présence du produit microbicide [27] (Figure 6). La majorité des études sur la résistance bactérienne aux antiseptiques a été réalisée en laboratoire et a utilisé des expérimentations ou des concentrations de produits qui n’ont pas lieu en pratique [28]. Certaines études rapportent des bactéries végétatives de l’environnement survivant dans des produits antiseptiques ou à des concentrations létales de principes actifs ou utilisées en milieu clinique [28,29]. La survie de ces bactéries dans les produits antiseptiques est souvent le résultat d’un mésusage du produit ou concerne plus rarement des bactéries naturellement résistantes [28]. Les bactéries végétatives résistantes à un principe actif sont souvent résistantes à d’autres principes actifs [18,19,29].
Les résistances croisées entre antiseptiques et antibiotiques
Il existe deux types de résistance associée entre antiseptiques et antibiotiques : la co-résistance et la résistance croisée [19]. La co-résistance est due à l’acquisition de gènes de résistance aux antiseptiques et aux antibiotiques colocalisés sur un même élément génétique mobile (notamment un plasmide). Par exemple, certains plasmides de staphylocoques peuvent porter des gènes de résistance aux antibiotiques (p. ex. mupirocine, pénicillines, aminosides, macrolides, tétracyclines) et des gènes de résistance aux antiseptiques (p. ex. chlorhexidine) [30]. Ces gènes peuvent donc être co-sélectionnés et transférés par conjugaison entre S. aureus et staphylocoques à coagulase négative, ces derniers pouvant constituer un réservoir de gènes de résistance. Une étude de cohorte rétrospective américaine (2005-2012) a montré une association significative entre le gène de résistance à la mupirocine mupA et le gène de résistance à la chlorhexidine qacA/B parmi les souches de S. aureus résistant à la méticilline (SARM) [31]. La résistance croisée est principalement liée à la capacité de certaines pompes d’efflux (plasmidiques ou chromosomiques) à excréter à la fois des antiseptiques et des antibiotiques. Il existe différentes familles de pompes d’efflux dont les profils de substrats sont variés [19,32,33,34] (Tableau V). À noter que les antiseptiques impliqués dans la résistance croisée par efflux actif incluent les ammoniums quaternaires, la chlorhexidine et le triclosan. L’exposition aux antiseptiques a donc potentiellement des effets collatéraux multiples sur la physiologie bactérienne incluant le risque de sélection de résistance croisée aux antibiotiques [35]. Il a été démontré in vitro que des concentrations sub-inhibitrices (CSI) d’antiseptiques (ammoniums quaternaires, chlorhexidine) pouvaient influencer la sensibilité aux antibiotiques. Par exemple, il a été montré que des CSI de chlorhexidine pouvaient entraîner une adaptation de souches de Klebsiella pneumoniae conduisant à une résistance à la chlorhexidine mais aussi à une résistance croisée à la colistine [36]. Chez Enterococcus faecium, il a été mis en évidence que des CSI de chlorhexidine induisaient l’expression des gènes vanHAX et liaXYZ impliqués respectivement dans la résistance à la vancomycine et à la daptomycine [37]. Il existe aussi des observations cliniques suggérant la pertinence de ces résistances associées entre antiseptiques et antibiotiques au sein des isolats cliniques. Par exemple, il a été identifié une association significative entre une diminution de sensibilité aux ammoniums quaternaires et un haut niveau de résistance aux antibiotiques (ampicilline et aminosides) chez des souches cliniques d’E. faecium [38]. Il a été rapporté un avantage de sélection d’une souche de K. pneumoniae résistante aux carbapénèmes hyper-épidémique (ST258) avec une concentration minimale inhibitrice de la chlorhexidine >128 mg/L [39]. Enfin, une étude clinique cas-contrôle a montré que la résistance à la mupirocine et la présence du gène qacA/B étaient associées à une colonisation persistante à SARM après décolonisation à la mupirocine nasale avec douche à la chlorhexidine (odds ratio : 3,4 ; p=0,004) [40]. Contrairement à ce qui se fait pour les antibiotiques, l’évaluation in vitro de la sensibilité aux antiseptiques est très rarement entreprise en pratique clinique, du fait d’un manque d’harmonisation de la terminologie (résistance vs tolérance vs sensibilité diminuée vs non-sensibilité vs non sauvage, etc.) et d’absence de critères d’interprétation [41]. Ainsi, il n’y a pas à ce jour de procédure standardisée facilement applicable en routine [41,42]. Cela empêche d’établir des concentrations critiques d’interprétation fiable et universelle et d’avoir une vision globale de l’épidémiologie de la résistance aux antiseptiques associée ou non aux antibiotiques.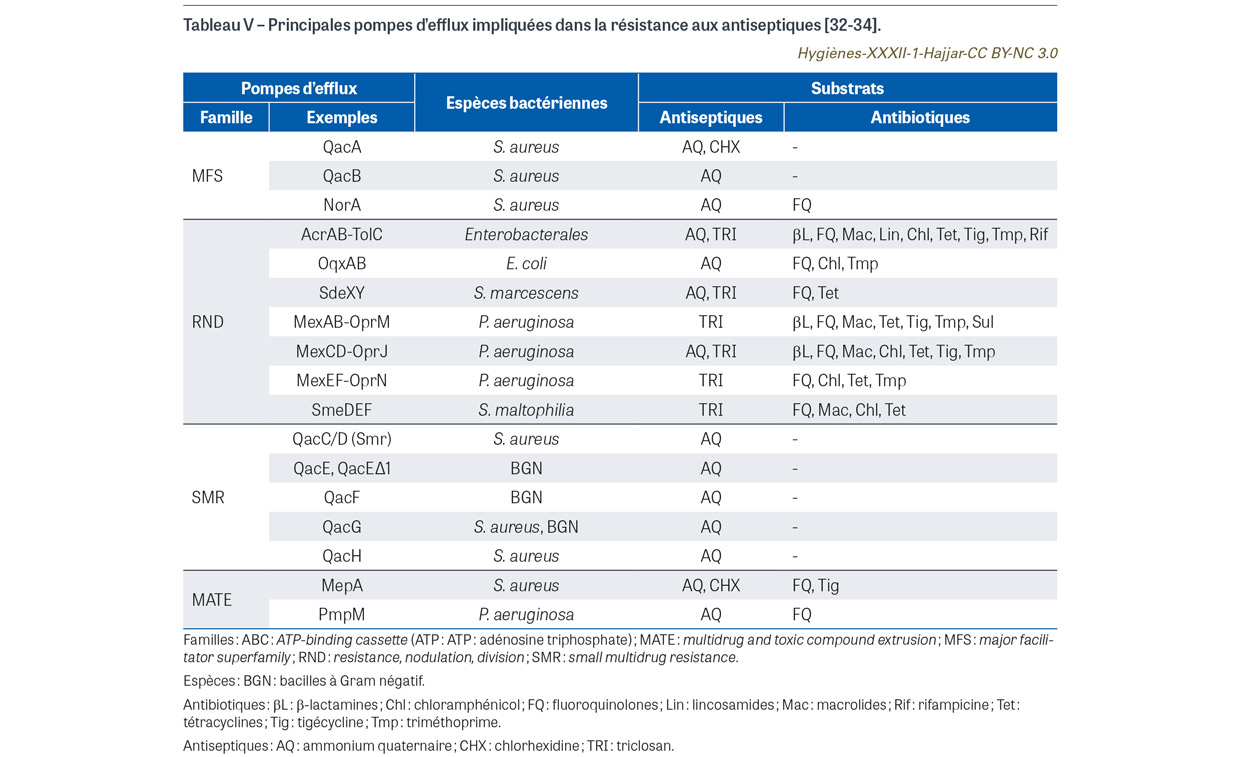
Les recommandations d’utilisation des antiseptiques en pratique clinique
Objectif
La pratique de la médecine repose actuellement sur le suivi de recommandations formalisées produites par les sociétés savantes et les tutelles de santé. L’objectif des recommandations est triple. Pour le patient, il s’agit d’améliorer la qualité des soins qui lui sont prodigués. Pour les praticiens, les recommandations représentent des outils dont le but est de faciliter leur exercice en les aidant à mettre leur pratique en cohérence avec les données actualisées de la littérature. Pour les gestionnaires des systèmes de santé, elles permettent de réduire l’hétérogénéité et de rationaliser l’offre de soins. Une certaine défiance envers les recommandations est constatée. L’expérience individuelle est souvent opposée à un mode de pensée reposant sur une approche collective. Une analyse systématique de la littérature a montré que les performances des praticiens diminuaient environ de moitié avec les années pour un ensemble d’objectifs [43]. Par ailleurs, les détracteurs des recommandations décrivent une médecine fondée sur un raisonnement raffiné et individualisé qui s’opposerait à une pratique de la médecine indiscriminée dans laquelle les recommandations se substitueraient à tout raisonnement médical. Cela reste caricatural, et nombre d’exemples ont démontré une association entre l’adhésion aux recommandations et l’amélioration du pronostic des patients ainsi que la rationalisation des pratiques [44]. La pratique médicale actuelle est suffisamment complexe pour être encadrée par des recommandations. C’est d’ailleurs le cas dans l’ensemble des secteurs porteurs de risque comme l’industrie ou l’aéronautique.
Élaboration
Les recommandations sont le fruit d’une synthèse entre l’expertise clinique, les données actualisées issues de la recherche clinique et les préférences des patients. Des règles internationales édictées par des groupes de méthodologistes encadrent chaque étape de la constitution d’une recommandation. Le système GRADE3 domine actuellement l’ensemble de la production des recommandations [45]. En France, la Haute Autorité de santé produit régulièrement des documents pour encadrer les pratiques en s’appuyant sur une méthode nationale [46]. L’élaboration d’une recommandation nécessite en premier lieu une question clinique pertinente, le plus souvent suggérée par une société savante. Un ou des coordinateurs sont alors chargés de constituer un groupe de travail qui est idéalement multidisciplinaire, multi-professionnel, équilibré entre les différentes composantes ayant trait avec la question posée, avec un niveau d’expertise reconnu dans le domaine. La présence d’usagers est essentielle dans les groupes de travail, et le développement d’associations d’usagers aptes à répondre à cette exigence reste nécessaire. La gestion des liens d’intérêt est primordiale car ils sont un biais reproché de façon récurrente par les détracteurs des recommandations [47]. Deux stratégies sont proposées : la première exige une déclaration de transparence à l’ensemble des intervenants, alors que la seconde exclut systématiquement tout intervenant déclarant un lien d’intérêt. Les deux stratégies ont des points forts et des points faibles. L’exclusion de tout intervenant avec lien d’intérêt garantit censément l’indépendance des intervenants, mais pourrait quelquefois réduire le niveau d’expertise et rendre difficile la mise en œuvre d’une recommandation. Le groupe de travail détermine quatre points capitaux pour la conduite de la recommandation qui sont désignés par l’acronyme PICO (P pour population, I pour intervention, C pour comparateur et O pour outcome, qu’on peut traduire ici par critère de jugement). Basée sur ces Pico, une bibliographie actualisée répondant à des critères définis est mise à la disposition du groupe de travail qui en fera une synthèse (quantitative, qualitative ou les deux), puis en extraira des recommandations. En l’absence de littérature, l’expertise clinique et les préférences des patients sont nécessaires pour proposer des recommandations. Traditionnellement, un court argumentaire explique chacune des recommandations. Enfin, celles-ci sont votées selon une méthode dite « Delphi » pour accepter ou rejeter chaque proposition. Plusieurs tours de vote et des révisions sont le plus souvent requis.
Niveau de preuve
Selon la Haute Autorité de santé, le niveau de preuve de chaque recommandation est gradé en trois catégories : fort, intermédiaire ou faible selon la littérature classée en preuve scientifique établie, présomption scientifique, faible niveau de preuve ou accord d’experts. Ensuite, le document final est relu, corrigé et harmonisé par le ou les coordinateurs. Un groupe de lecture prédéterminé, multi-professionnel et multidisciplinaire, valide le document. La diffusion du document auprès des utilisateurs et l’évaluation de l’adhésion après sa mise en œuvre sont des étapes aussi importantes que les précédentes. En bref, une recommandation de fort niveau de preuve, basée sur une littérature établie, sera difficilement contournable dans la pratique routinière. Les recommandations internationales résument cette approche par l’injonction « il faut ». Une recommandation de niveau de preuve faible basée sur un accord d’experts pourra faire l’objet de discussions pour son application, la préférence du patient étant alors à évaluer. Les recommandations internationales résument cette approche par la désignation « il est possible de faire ». Pour l’antisepsie cutanée, la désinfection large du site opératoire est basée sur des preuves scientifiques établies, tout comme la recommandation de veiller à l’absence de collection d’antiseptique alcoolique afin de prévenir le risque de brûlure lors de l’utilisation du bistouri électrique. En contraste, la possibilité d’utiliser une solution alcoolique de chlorhexidine ou de povidone iodée repose sur un faible niveau de preuve [9].
Application
L’application des recommandations dans le domaine de la santé reste médiocre. En soins critiques, une étude basée sur un audit d’un jour avait montré une adhésion de seulement 24% à un bouquet de recommandations promu par la campagne Survivre au sepsis [48]. Le suivi de la publication des recommandations françaises sur la prise en charge de la pneumonie associée aux soins a montré un taux de compliance de 47% (38%-56%) dans un groupe interventionnel recevant une formation spécifique sur ces recommandations et de 42% (25%-53%) dans le groupe contrôle [49]. Au bloc opératoire, les performances sont bien meilleures mais restent imparfaites [50]. Les obstacles à la mise en place des recommandations sont de plusieurs ordres : la connaissance de la recommandation, l’accord avec la recommandation, l’adoption de cette recommandation, et enfin l’adhésion à cette recommandation [51]. En dépit de certaines limites, la production de recommandations établies selon une méthode validée améliore la qualité des soins et rationalise les approches diagnostiques et thérapeutiques. Une bonne connaissance de la méthodologie des recommandations permet de sélectionner les documents sur lesquels doit reposer la pratique clinique.
Conclusion
Les mécanismes de résistance bactérienne décrits concernent les bactéries planctoniques et non les biofilms bactériens qui ont leurs propres mécanismes de résistance. Malgré les nombreuses études de laboratoires rapportant le développement d’une résistance bactérienne aux antiseptiques, parfois associée à des résistances croisées aux antibiotiques, des incertitudes subsistent quant à leur impact clinique. D’une part, la majorité de ces études définissent la résistance bactérienne aux antiseptiques par une augmentation de la concentration minimale inhibitrice, concentration qui est bien au-dessous de la concentration utilisée en pratique. D’autre part, l’exposition des bactéries au seul principe actif n’est pas représentative des formulations complexes des produits commercialisés. Si la compréhension de l’impact clinique des antiseptiques sur l’émergence de résistances bactériennes, de résistances croisées et de la dissémination de mécanismes de résistance reste limitée, voire spéculative, le mésusage de ces produits doit être prévenu pour préserver leur efficacité tant leur utilisation est essentielle pour le contrôle infectieux. Pour les professionnels de santé, des formations aux modalités d’un bon usage des antiseptiques permettent d’améliorer la qualité de la phase d’antisepsie avant les gestes invasifs. Les missions Spiadi et Spicmi proposent des outils pédagogiques spécifiques pour réaliser ces formations. Les recommandations de bonne pratique, indépendamment de leur qualité, ne représentent jamais un obstacle au raisonnement médical et à la personnalisation du soin, mais constituent une aide pour progresser dans le soin.
Notes :
1- Info-ATBVAC est un portail francophone indépendant (Éléments Santé, Clermont-Ferrand, France) de formation et d’actualités sur l’antibiothérapie et la vaccinologie.
2- Pour peripherally inserted central catheter.
3- Grading of Recommendations Assessment, Development and Evaluation (système de notation des recommandations, évaluation, élaboration et évaluation de l’Organisation mondiale de la santé).