Introduction : les infections à Clostridioides difficile
Clostridioides difficile est un bacille à Gram positif anaérobie, capable de sporuler, provoquant des infections digestives pouvant aller de la diarrhée simple à la colite pseudomembraneuse. C’est la première cause de diarrhée infectieuse associée aux soins chez l’adulte. Les symptômes digestifs sont dus à la production de toxines par la bactérie : les toxines A et B (TcdA et TcdB, respectivement), et la toxine binaire pour certaines souches. Les souches non toxinogènes sont considérées comme non pathogènes. Les principaux facteurs de risque d’infection par C. difficile (ICD) sont l’âge supérieur à 65 ans, la prise récente d’antibiotiques (en particulier les céphalosporines, l’amoxicilline associée à l’acide clavulanique, les fluoroquinolones et la clindamycine), les médicaments inducteurs de dysbiose tels que les inhibiteurs de pompe à protons ou les laxatifs, et une hospitalisation récente ou prolongée [1]. Les recommandations européennes pour le traitement des ICD ont été révisées en 2021 [2]. La fidaxomicine est maintenant recommandée en première intention en monothérapie pour le traitement d’un premier épisode d’ICD, et l’association d’un traitement standard avec le bezlotoxumab (anticorps monoclonal anti-toxine B) pour le traitement d’une première récidive. À partir de la deuxième récidive, une transplantation de microbiote fécal (TMF) est préconisée.
Relations entre C. difficile et le microbiote intestinal
La contamination des patients par C. difficile se fait par l’ingestion de spores, fréquemment retrouvées dans l’environnement. Une fois parvenues dans l’intestin, les spores germinent en formes végétatives sous l’action des sels biliaires et colonisent le côlon. Cette étape de colonisation est favorisée par un déséquilibre du microbiote intestinal (dysbiose). C’est pourquoi la restauration rapide d’un microbiote intestinal équilibré (eubiose) est primordiale dans la prise en charge des patients souffrant d’ICD et dans la prévention de ces infections. De nombreuses études ont montré que les ICD s’accompagnaient d’une diminution de la richesse et de la diversité bactériennes du microbiote intestinal [3,4,5].
Acides gras à chaîne courte
Parmi les taxons bactériens dont l’abondance est diminuée chez les patients atteints d’ICD, on retrouve les genres Bacteroides et Bifidobacterium ainsi que des familles de bactéries productrices de butyrate comme les Ruminococcaceae et les Lachnospiraceae. Le butyrate appartient à la famille des acides gras à chaîne courte (AGCC), un ensemble de métabolites comprenant également l’acétate, le propionate ou encore le valérate. Les AGCC sont produits par les bactéries du microbiote intestinal par fermentation des glucides complexes non digérés. Ils sont impliqués dans l’homéostasie intestinale, et plus largement dans l’état de santé de l’hôte. Ces molécules jouent le rôle de source d’énergie pour les colonocytes et réduisent l’inflammation intestinale. Plusieurs études ont mis en évidence le rôle protecteur ou au contraire délétère de certains AGCC vis-à-vis de l’ICD [6] (Figure 1). Le butyrate améliore l’intégrité de la barrière épithéliale en augmentant l’expression des protéines de jonctions serrées, diminue la translocation bactérienne, module le recrutement des polynucléaires neutrophiles et des cellules T régulatrices dans la lamina propria, et stabilise les taux de cytokines pro-inflammatoires [7,8]. L’acétate améliore la réponse immunitaire de l’hôte et active la sécrétion de cytokines anti-inflammatoires. Le valérate est capable d’inhiber la croissance des formes végétatives de C. difficile [9]. À l’inverse, le succinate favorise la prolifération de C. difficile après une antibiothérapie [10].
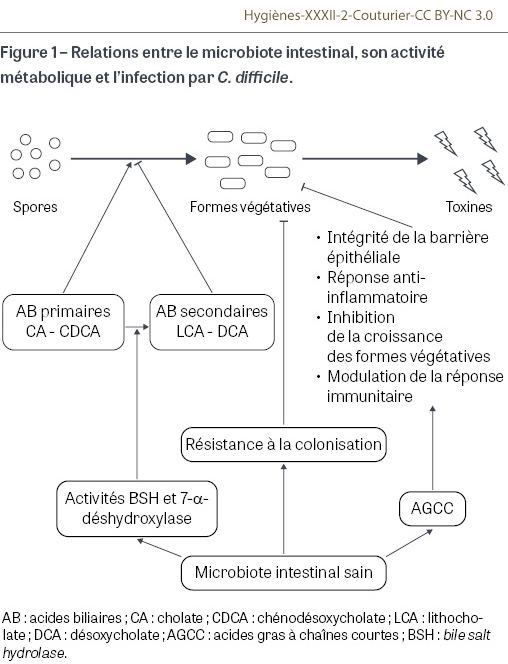
Acides biliaires
Outre les AGCC, le métabolisme des acides biliaires joue un rôle clé dans la pathogénie des ICD [11]. Le foie produit les acides biliaires primaires (les acides cholique et chénodésoxycholique, aussi appelés cholate et chénodésoxycholate), qui sont ensuite conjugués à la glycine ou à la taurine (aboutissant notamment à la formation du taurocholate) puis libérés dans l’intestin. La fonction principale des acides biliaires est d’émulsionner et d’absorber les graisses. Environ 95% des acides biliaires primaires conjugués et non conjugués sont réabsorbés lors du cycle entéro-hépatique. Les 5% restants sont biotransformés par les bactéries du microbiote intestinal en acides biliaires secondaires (désoxycholate et lithocholate). Cette étape fait intervenir des enzymes essentielles comme les hydrolases des sels biliaires, ou bile salt hydrolases, dont le rôle est de déconjuguer les acides biliaires primaires, qui sont produits notamment par les bactéries des genres Bacteroides, Blautia, Eubacterium, Clostridium et Roseburia [12] et la 7-α-déshydroxylase retrouvée chez certains groupes bactériens appartenant aux Ruminococcaceae, Lachnospiraceae et Peptostreptococcaceae, et qui permet la formation des acides biliaires secondaires à partir des acides biliaires primaires déconjugués [13]. Les acides biliaires primaires cholate et taurocholate ont un effet germinant sur les spores de C. difficile, tandis que le chénodésoxycholate et les acides biliaires secondaires ont un effet inhibiteur sur la germination et la croissance des formes végétatives [14,15]. Ainsi, des modifications compositionnelles dans les populations bactériennes du microbiote intestinal de l’hôte peuvent influer sur le profil en acides biliaires, donc favoriser ou non la colonisation et l’infection par C. difficile. En raison de ces multiples relations complexes entre le microbiote intestinal et C. difficile, différents axes de modulation du microbiote sont disponibles ou en développement dans le cadre de la prévention ou du traitement des ICD. La physiopathologie des ICD et le microbiote intestinal sont étroitement liés via différents paramètres, tels que la composition bactérienne du microbiote intestinal et ses capacités métaboliques (AGCC et acides biliaires).
La transplantation de microbiote fécal (TMF)
La transplantation de microbiote fécal (TMF) consiste à administrer les selles d’un donneur sain à une personne malade dans le but de corriger la dysbiose associée à sa pathologie. Ce concept a été décrit pour la première fois au IVe siècle en Chine avec le traitement de diarrhées sévères par des suspensions de selles humaines (Handy therapy for emergencies, manuel de médecine d’urgence1). Depuis le début des années 2010, la TMF connaît un regain d’intérêt de la part de la communauté scientifique et médicale et de nombreuses applications sont en cours d’évaluation, par exemple pour les maladies inflammatoires chroniques de l’intestin, l’obésité ou encore le diabète. En France, les ICD multirécidivantes (≥2 récidives) sont la seule indication de la TMF dans le cadre du soin courant. Le transplant de microbiote fécal est une préparation pharmaceutique, il est donc considéré comme un médicament. Les recommandations pour la pratique clinique émises par le Groupe français de transplantation fécale (GFTF) précisent en particulier le processus de sélection des donneurs, la séquence thérapeutique à respecter et les différentes procédures d’administration possibles [16]. Les éventuels critères d’exclusion (hospitalisation à l’étranger dans l’année, pathologies digestives, antibiothérapie dans les trois mois précédents…) sont recherchés chez le donneur par un questionnaire. Un examen clinique est effectué, ainsi que la recherche d’agents infectieux par sérologie et examen microbiologique et parasitologique des selles. La TMF (selles fraîches ou congelées) peut être administrée par voie basse (lavement ou coloscopie) ou par voie haute (sonde naso-gastrique ou naso-duodénale). Dans une perspective d’amélioration du processus d’administration, plusieurs études ont proposé une alternative par gélule gastro-résistante de lyophilisat de selles ou de microbiote fécal congelé [17,18]. Récemment, une étude rétrospective a été menée chez 617 patients ayant été traités par TMF entre 2018 et 2022 dans 17 centres répartis sur le territoire français [19]. L’efficacité globale de la TMF était de 84,3% (520/617), avec 0,5% d’effets indésirables possiblement liés à la TMF (3/658). Aucun mode d’administration n’était associé avec le taux de succès de la TMF et l’utilisation de selles natives congelées dans les six heures après émission sans ajout de glycérol ne diminuait pas l’efficacité de la TMF. Dans cette étude, le taux de succès de la TMF à la première récidive d’ICD était similaire au taux de succès global (85,1%). Un essai clinique randomisé contrôlé en double aveugle contre placebo (EarlyFMT) a par ailleurs récemment démontré l’efficacité et la sécurité de la TMF dans le traitement d’un premier ou d’un second épisode d’ICD [20]. La TMF pourra donc probablement être envisagée dans le traitement d’un premier épisode d’ICD par les futures recommandations de prise en charge [1]. Malgré une remarquable efficacité de la TMF dans le traitement des ICD récidivantes, les risques à long terme liés à son utilisation restent méconnus. C’est pourquoi différentes alternatives thérapeutiques visant à restaurer le microbiote intestinal ont été développées ou sont en cours d’évaluation. La TMF, qui permet de restaurer l’intégrité du microbiote intestinal, est maintenant recommandée dans la prise en charge des ICD multirécidivantes, avec un fort taux de succès thérapeutique.
Les autres options de modulation du microbiote intestinal pour la prévention et le traitement des infections à C. difficile
Produits biothérapeutiques vivants et substances d’origine humaine
Les produits biothérapeutiques vivants (ci-après LBP pour live biotherapeutic products) sont définis par la Food and Drug Administration2 (FDA) comme des produits biologiques non vaccinaux contenant des organismes vivants pour la prévention ou le traitement d’une pathologie humaine. À la différence des probiotiques, ces LBP ont un statut de médicament et doivent se conformer à un cadre réglementaire strict [21,22,23]. En Europe, depuis 2022, les produits dérivés de microbiotes humains sont soumis à la réglementation des substances d’origine humaine (SoHO pour substances of human origin) [24]. Cette réglementation devrait permettre une harmonisation et des échanges plus aisés entre pays membres de l’Union Européenne.
Vowst® (SER-109)
Étant donné l’importance des Firmicutes (aujourd’hui Bacillota) dans la résistance à la colonisation, une capsule orale appelée SER-109 (nom commercial Vowst®, Seres Therapeutics, Cambridge, MA, États-Unis) et contenant une cinquantaine de spores de Firmicutes différentes purifiées à partir de selles de donneurs sains a été développée [25]. Une étude exploratoire menée chez 30 patients a montré que l’administration de SER-109 était associée à une augmentation de la diversité bactérienne du microbiote intestinal (indice de Chao1 basal à 24±8 contre 31±5 huit semaines après administration de SER-109) avec une augmentation des bactéries commensales et une diminution des bactéries pathogènes [25]. Un essai clinique de phase III randomisé et contrôlé en double aveugle réalisé chez 182 patients (ECOSPOR III, NCT03183128) a montré l’efficacité de cette option thérapeutique dans la prévention des ICD récidivantes [26]. Dans le groupe ayant reçu quatre capsules de Vowst® par jour pendant trois jours, 12% des patients ont souffert d’une récidive à huit semaines, contre 40% dans le groupe placebo (risque relatif 0,32 ; IC95 [0,18-0,58] ; p<0,001). L’incidence des effets indésirables était similaire dans les deux groupes, il s’agissait majoritairement d’effets gastro-intestinaux légers à modérés. Le Vowst® induisait des modifications compositionnelles et métabolomiques du microbiote intestinal, notamment l’implantation rapide des Firmicutes et une plus forte augmentation des acides biliaires secondaires. Un essai clinique ouvert à un seul bras de phase III (ECOSPOR IV) incluant 263 patients a évalué la sécurité et la tolérance du Vowst® [27]. Les taux d’ICD récidivantes à huit semaines et 24 semaines étaient respectivement de 8,7% (28/263) et 13,7% (36/263). Des effets indésirables gastro-intestinaux légers à modérés ont été observés chez 141 patients et aucun décès lié au traitement n’a été rapporté. Le Vowst® a été approuvé en avril 2023 par la FDA comme le premier produit oral issu du microbiote fécal dans la prévention des ICD récidivantes chez l’adulte de plus de 18 ans.
Rebyota® (RBX2660)
Le RBX2660 (nom commercial Rebyota®, Ferring Pharmaceutical, Saint-Prex, Suisse) est une suspension de microbiote fécal obtenue à partir de dons de volontaires sains. Son administration se fait par voie rectale monodose. Un essai clinique multicentrique ouvert de phase II (NCT02589847) incluant 162 patients a montré que le taux de succès clinique dans le groupe ayant reçu le Rebyota® était significativement meilleur que dans le groupe contrôle (78,9% contre 30,7%) [28]. Parmi les patients répondeurs, 91% sont restés indemnes d’ICD pendant 24 mois. La composition et la diversité du microbiote intestinal des répondeurs étaient proches de celles du Rebyota®. L’efficacité du Rebyota® dans la prévention des récidives a été évaluée par un essai clinique de phase III randomisé contrôlé en double aveugle, PUNCH CD3 (NCT03244644), chez 267 patients souffrant d’ICD récidivantes [29]. Le taux de succès, défini comme l’absence d’ICD dans les huit semaines après l’étude, était de 70,6% chez les patients ayant reçu le RBX2660 et de 57,5% chez les patients traités par placebo. Une analyse posthoc de l’étude PUNCH CD3 a également montré que le Rebyota® était associé à une meilleure qualité de vie chez les patients à la première récidive d’ICD [30]. L’utilisation du Rebyota® a été approuvée en novembre 2022 par la FDA en prévention des ICD récidivantes chez l’adulte de plus de 18 ans.
VE303
Le VE303 (Vedanta Biosciences Inc, Cambridge, MA, États-Unis) est composé de huit souches commensales non pathogènes et non toxinogènes de Clostridia provenant de selles de volontaires sains et obtenues par culture bactérienne à partir de banques de cellules clonales. Un essai clinique de phase I a montré que cette option thérapeutique était bien tolérée et sans danger et que le VE303 colonisait efficacement l’intestin [31]. L’administration du VE303 était favorable à l’établissement de communautés microbiennes impliquées dans la résistance à la colonisation et était associée à des concentrations d’acides biliaires et d’AGCC augmentées. Ce LBP a fait l’objet d’un essai clinique de phase II randomisé contrôlé (NCT03788434) qui a comparé 79 patients recevant une forte dose de VE303 (8.109 unités formant colonie [UFC]), une faible dose de VE303 (1,6.109 UFC) ou un placebo par voie orale pendant 14 jours [32]. Les taux de récidive d’ICD à 8 semaines étaient respectivement de 13,8%, 37,0% et 45,5% dans les groupes forte dose, faible dose et placebo (p=0,006 pour la comparaison forte dose vs placebo). Un essai clinique de phase III (NCT06237452) est en cours d’inclusion pour l’évaluation de l’efficacité du VE303 dans la prévention des ICD récidivantes.
Probiotiques
Sont définis comme probiotiques des micro-organismes qui, lorsqu’ils sont administrés en quantité suffisante, exercent des effets positifs sur la santé de l’hôte. Saccharomyces boulardii, certaines souches de Lactobacillus ou encore de Bifidobacterium sont des probiotiques largement utilisés. Plusieurs études ont montré que les probiotiques avaient la capacité de moduler la composition du microbiote intestinal et de conférer une protection vis-à-vis de l’ICD. Wu et al. ont montré que, chez la souris, Akkermansia muciniphila exerçait un effet protecteur contre C. difficile en agissant sur le microbiote et sur la réponse anti-inflammatoire [33]. Plusieurs études cliniques ont évalué l’efficacité des probiotiques en prévention de l’ICD avec des résultats mitigés. MacFarland et al. ont évalué l’effet de S. boulardii en association avec l’antibiothérapie dans une étude randomisée contrôlée incluant 124 patients [34]. Le taux de récidive d’ICD chez les patients traités par S. boulardii était inférieur à celui du groupe placebo (risque relatif 0,43 ; IC95 [0,20-0,97]). Toutefois, une étude multicentrique récente a montré que l’utilisation de probiotiques au moment de la prescription d’antibiotiques ne modifiait pas la proportion d’ICD (odd ratio [OR] 1,46 ; IC95 [0,87-2,45]) [35]. Un autre essai randomisé contrôlé en double aveugle effectué chez 2 941 patients âgés d’au moins 65 ans, l’essai PLACIDE (ISRCTN70017204), a montré que l’administration d’une association de lactobacilles et de bifidobactéries n’avait pas d’effet sur la prévention des diarrhées associées aux antibiotiques et des ICD [36]. En raison de données insuffisantes, les principales sociétés savantes (European Society of Clinical Microbiology and Infectious Diseases, Infectious Diseases Society of America, American College of Gastroenterology) ne recommandent pas l’utilisation des probiotiques en prévention de l’ICD [1].
Souches de C. difficile non toxinogènes : VP20621
Des études observationnelles ont montré que les patients colonisés par une souche de C. difficile non toxinogène avaient moins de risque de développer une ICD que les patients non colonisés, sans que le mécanisme de cette protection soit clairement démontré [37]. Dans ce contexte, une suspension de spores de la souche non toxinogène M3, le VP20621, a fait l’objet d’un essai clinique de phase II randomisé contrôlé incluant 168 patients [38]. Le taux d’ICD récidivantes était de 30% chez les patients ayant reçu le placebo, et de 11% chez les patients ayant reçu la souche M3 (OR : 0,28 ; IC95 [0,11-0,69] ; p=0,006). Parmi les 125 patients ayant reçu la souche M3, une récidive est survenue chez 2% de ceux qui étaient colonisés, contre 31% de ceux qui ne l’étaient pas (OR : 0,01 ; IC95 [0,00-0,05] ; p<0,001). Cependant, le possible transfert de gènes codant les toxines d’une souche toxinogène à une souche non toxinogène rend l’utilisation de cette option thérapeutique incertaine.
Souches de Clostridium scindens
Clostridium scindens est une bactérie possédant un opéron inductible par les acides biliaires (opéron bai) qui intervient dans la synthèse des acides biliaires secondaires en régulant l’expression de la 7α-déshydroxylase [39]. Plusieurs études ont montré que C. scindens jouait un rôle crucial dans la prévention de la colonisation par C. difficile [40]. En modèle murin d’ICD, une diminution de l’expression des hydrolases des sels biliaires et de la 7α-déshydroxylase dans le contenu cæcal a été observée, conjointement à une diminution de l’expression des gènes correspondant chez les Lachnospiraceae et Clostridiaceae [41]. Buffie et al. ont combiné l’analyse du microbiote intestinal de patients hospitalisés avec l’étude d’un modèle murin d’ICD pour montrer que C. scindens était associé à une augmentation de la synthèse des acides biliaires secondaires conférant une résistance à l’ICD [42]. Par ailleurs, C. scindens est capable de réduire la production des toxines A et B par C. difficile et de réduire le nombre de bactéries pathogènes en inhibant la formation de biofilm [41,43]. Des investigations plus poussées restent nécessaires concernant C. scindens, qui pourrait représenter une approche thérapeutique intéressante dans la prise en charge de l’ICD.
Bactéries productrices de butyrate
Le butyrate est un des AGCC les plus abondants dans l’intestin humain et joue un rôle protecteur vis-à-vis de l’ICD. Clostridium butyricum est une espèce bactérienne productrice de butyrate dont l’utilisation a été évaluée pour la protection contre les ICD. Dans un modèle murin d’infection, la souche CBM 588 en association avec la fidaxomicine a permis d’améliorer la résistance à la colonisation par C. difficile et d’atténuer l’inflammation intestinale en comparaison d’une monothérapie par fidaxomicine [44]. Ces effets bénéfiques étaient en particulier liés à la modulation du microbiote intestinal (augmentation de la proportion de Lactobacillus spp. et Lactococcus spp.) entraînant une diminution de la concentration en succinate et une inhibition de la prolifération de C. difficile. L’efficacité de C. butyricum en prévention de l’ICD reste peu étudiée et l’utilisation de cette bactérie nécessite des études plus approfondies.
Inhibiteurs d’antibiotiques
DAV132
Le DAV132 (Da Volterra, Paris, France) est constitué de microbilles de charbon activé recouvertes d’un polymère insoluble dans l’estomac et l’intestin grêle. Le polymère se dissout au niveau du côlon, libérant le charbon qui peut ainsi adsorber et inactiver les résidus d’antibiotiques. Dans un essai clinique randomisé de phase II réalisé chez 243 patients traités par fluoroquinolones [45], il a été observé que le DAV132 ne modifiait pas la concentration plasmatique d’antibiotique, mais réduisait de plus de 98% le taux de fluoroquinolones dans les selles (p<0,001). La diversité bactérienne du microbiote intestinal était moins altérée (p=0,003) et la résistance à la colonisation par C. difficile ex vivo (p=0,0003) était augmentée chez les patients ayant reçu le DAV132. Cependant, des études investiguant l’effet du DAV132 sur l’incidence des ICD chez les patients traités par antibiotiques restent nécessaires. La société Da Volterra a été déclarée en faillite en mars 2024 par le tribunal de commerce, ce qui rend incertaine la poursuite des essais.
Ribaxamase
La ribaxamase (ou SYN-004, Synthetic Biologics, Rockville, MD, États-Unis) est une enzyme de la classe des bêtalactamases capable de dégrader les antibiotiques de la famille des bêtalactamines et ainsi de réduire leur impact sur le microbiote intestinal. Un essai clinique de phase IIb randomisé contrôlé (NCT02563106) a été mené chez 413 patients souffrant d’une infection respiratoire basse et traités par ceftriaxone [46]. Le traitement par ribaxamase a permis de réduire le risque d’ICD de 3,4% à 1% (IC95 [-0,6-5,9] ; p=0,045). L’incidence d’effets indésirables était similaire entre les deux groupes, hormis l’incidence des décès liés à une cause cardiovasculaire, qui était supérieure dans le groupe ayant reçu la ribaxamase (2,9% vs 0,5%).
Phagothérapie
Les bactériophages sont des virus spécifiques des bactéries pouvant jouer un rôle anti-infectieux en raison de leur pouvoir lytique. L’émergence de la résistance de C. difficile aux antibiotiques utilisés habituellement dans le traitement de l’ICD représente une problématique potentielle. La phagothérapie pourrait donc représenter une alternative thérapeutique prometteuse [47]. En effet, en raison du spectre d’hôte étroit des bactériophages, leur utilisation n’entraîne pas d’aggravation de la dysbiose associée à l’ICD et aux récidives. De plus, les bactériophages se répliquant au niveau du site infectieux, la dose effective est amplifiée. Enfin, la capacité de pénétration du biofilm des bactériophages représente un autre avantage de cette option thérapeutique. Dans un modèle in vitro de côlon humain, un traitement par le bactériophage φ CD27 a permis de diminuer le nombre de cellules végétatives de C. difficile et la quantité de toxines [48]. Plusieurs essais en modèle animal ont montré des résultats prometteurs, notamment chez le hamster, la souris et Galleria mellonella [49]. Cependant, la phagothérapie s’accompagne de difficultés techniques (manque de connaissances sur la relation entre le bactériophage et son hôte, problématiques pharmacocinétiques…) et aucune étude n’est à l’heure actuelle disponible chez l’humain. Par ailleurs, la lysogénie (intégration du bactériophage au génome bactérien) représente un obstacle pour l’utilisation de la phagothérapie. L’utilisation de cocktails de phages ou de phages modifiés génétiquement pourrait permettre à moyen terme l’emploi de la phagothérapie en pratique clinique. De nombreuses options de modulation du microbiote intestinal sont en cours de développement dans le cadre de la prise en charge de l’ICD.
Conclusion
Les relations entre C. difficile, le microbiote intestinal et l’hôte sont régies par des interactions complexes et multiples. De nombreuses possibilités de modulation des populations bactériennes du microbiote intestinal existent et sont soit déjà disponibles pour la prévention ou le traitement des ICD, comme la transplantation de microbiote fécal qui est recommandée pour les infections récidivantes en soin courant, soit en cours d’évaluation.
Notes :
1- Attribué à Ge Hong, cité dans Zhang F, Cui B, He X, et al. Microbiota transplantation: concept, methodology and strategy for its modernization. Protein Cell. 2018;9(5):462-473.
2- Administration américaine des denrées alimentaires et des médicaments.