Objectifs des prélèvements de surface
Les prélèvements de surface peuvent avoir deux types d’objectifs :
- s’assurer de la qualité microbiologique d’un environnement maîtrisé après la mise en place d’un certain nombre de procédures, indicateurs, audits de pratiques… C’est le cas par exemple du bloc opératoire, des unités de reconstitution de cytostatiques ou de stérilisation. Nous ne nous attarderons pas sur cette approche, bien encadrée par des normes techniques et recommandations d’interprétation. Les surfaces choisies sont faciles à prélever. Les résultats microbiologiques rendus sont le plus souvent quantitatifs en unités formant colonies (UFC) par cm2 de flore totale sans recherche spécifique d’un micro-organisme particulier [4] ;
- rechercher spécifiquement un micro-organisme afin d’identifier puis de maîtriser une voie de transmission impliquant les surfaces comme réservoir secondaire. Nous nous focaliserons sur cette utilisation des prélèvements de surface.
Pour être exhaustif, les prélèvements de surface peuvent également être utilisés dans un but pédagogique : indépendamment du type de micro-organismes identifiés, ils permettent de visualiser la présence de micro-organismes sur des surfaces fréquemment touchées (poignée de porte de réfrigérateur, lame de couteau de cuisine…) afin d’inciter à la réalisation du bionettoyage des surfaces ou de l’hygiène des mains.
Modalités et principes des prélèvements de surface
La recherche d’un micro-organisme spécifique sur une surface se compose de plusieurs étapes complémentaires dont dépend la qualité finale de l’analyse :
- le recueil de matériel biologique à partir de la surface concernée ;
- le relargage du matériel biologique dans un milieu propice à l’identification de l’agent infectieux recherché ;
- l’identification proprement dite des micro-organismes ciblés, par culture ou par technique génomique ;
- le cas échéant la quantification ou semi-quantification du micro-organisme ;
- l’interprétation de ce résultat qualitatif ou quantitatif.
À chacune de ces étapes, des interférences peuvent exister et fausser le résultat final obtenu ; l’interprétation que l’hygiéniste fait de ces résultats peut s’en trouver perturbée. Pour que ces recherches soient reproductibles et répétables (c’est-à-dire qu’elles produisent les mêmes résultats si différents opérateurs les réitèrent plusieurs fois), il faut que chaque étape soit standardisée donc réalisée strictement de la même façon. Cela est d’autant plus important si la recherche se veut quantitative et si l’on veut comparer plusieurs résultats dans le temps ou dans l’espace. Il s’avère que ces conditions sont assez difficiles à remplir dans la pratique quotidienne. Il existe différentes normes encadrant les prélèvements de surface, notamment en microbiologie de la chaîne alimentaire [5,6]. Nous nous focaliserons sur la déclinaison de ces approches dans un contexte hospitalier.
Performances analytiques et limites de l’approche
Recueil du matériel biologique à partir de la surface
La première étape de la réalisation d’une analyse de surface conditionne la qualité de la recherche. En effet, la technique de prélèvement utilisée doit extraire l’agent infectieux présent sur une surface dont les contours peuvent varier.
Surface plane
La surface plane est la situation la plus simple. Pour les recherches basées sur la culture du micro-organisme, il est possible d’appliquer directement le milieu de culture sur la surface. Des géloses commercialisées spécifiques dans lesquelles le milieu de culture déborde de la boîte de Pétri sont disponibles ; elles représentent une surface de 25 cm2 (Figure 1). Leur application sur la surface gagne à être standardisée en recommandant une pression de 500 g pendant 10 secondes. Des dispositifs « applicateurs » existent qui exercent la pression adéquate à l’aide d’un ressort calibré avec une minuterie qui sonne au bout de 10 secondes. Si la technique de détection nécessite une remise en suspension des micro-organismes (cf. infra), il est possible de standardiser la surface prélevée (généralement 10x10 cm2) en découpant un pochoir de cette taille dans un matériel supportant l’application d’un détergeant désinfectant. La surface sera alors prélevée à l’aide d’un écouvillon ou d’une compresse stérile en respectant les contours du cadre fabriqué. La pression exercée lors du prélèvement est un facteur dont dépend l’efficacité (ou rendement) de l’analyse ; elle est néanmoins difficile à standardiser manuellement.
Surface ou objet de forme plus ou moins complexe
Dans le cas d’un objet complexe, la difficulté est de prendre en compte l’ensemble des surfaces à prélever, en incluant les aspérités et les parties en creux propices à la prolifération d’agents infectieux. Si la taille de l’objet le permet, il peut être introduit dans un volume suffisant de bouillon de culture. L’action d’ultrasons peut également favoriser le décollement des micro-organismes des surfaces colonisées. Dans le cas contraire, un écouvillonnage soigneux ou l’utilisation de chiffonnettes ou de compresses stériles peuvent constituer des solutions imparfaites mais pragmatiques. La capacité à détacher les micro-organismes présents sur cette surface parfois depuis une longue durée, éventuellement sous la forme d’un biofilm (ensemble de micro-organismes entourés d’une matrice glycoprotéique) adhérant, est un paramètre important pour la sensibilité de la technique, c’est-à-dire sa performance à identifier le micro-organisme recherché s’il est présent sur la surface. L’humidification préalable des écouvillons secs utilisés est historiquement recommandée : son impact est néanmoins discuté et variable selon la nature des surfaces prélevées [7,8,9]. D’autres paramètres peuvent également intervenir dans l’efficacité du prélèvement : à titre d’exemple, dans le cas du prélèvement d’incubateurs en néonatologie, il a été montré récemment que les résultats pouvaient être très différents si l’incubateur était en fonctionnement ou à l’arrêt [10].
Relargage
Le relargage des micro-organismes dans le milieu utilisé pour leur détection est une étape dont les conséquences sont souvent négligées. Les performances des écouvillons pour cette étape varient selon leur composition, bien qu’il soit difficile de faire la part des performances de ces matériels entre les étapes de prélèvement et de relargage. Depuis plus de dix ans, les écouvillons floqués ont progressivement remplacé les écouvillons standards. L’impact de cette technologie à la fois sur la collecte et le relargage des micro-organismes semble cliniquement significatif : dans l’étude de Verhoeven et al., le pourcentage de volontaires trouvés porteurs de Staphylococcus aureus au niveau nasal était significativement supérieur avec ce type d’écouvillon et la charge bactérienne était plus élevée [11]. L’arrivée de nouveaux écouvillons en mousse a remis en cause cette hiérarchie : l’analyse de plusieurs types d’écouvillons sur plusieurs surfaces montre néanmoins des résultats variables en fonction des modèles testés [12]. L’utilisation des ultrasons évoquée précédemment peut aussi être une solution intéressante pour décrocher des micro-organismes fixés sur un matériel inerte. Cette approche a été largement étudiée dans le cadre du diagnostic d’infection sur matériel implantable [13]. Un excès d’ultrasons peut néanmoins avoir des conséquences délétères sur la vitalité des micro-organismes.
Détection
L’étape de détection peut être réalisée par culture microbienne ou par détection génomique (Tableau I).
Détection par culture
La détection par culture présente l’avantage d’être simple et peu coûteuse. De plus elle permet d’isoler la souche microbienne correspondante et de la comparer à celles identifiées chez des patients2. Elle doit faire face néanmoins à plusieurs écueils :
- la présence de désinfectants sur les surfaces doit être neutralisée. Les géloses commercialisées pour les prélèvements de surface peuvent contenir un neutralisant, comme les solutions de prélèvement d’endoscopes, qui gagnent ainsi à être utilisées dans ce contexte ;
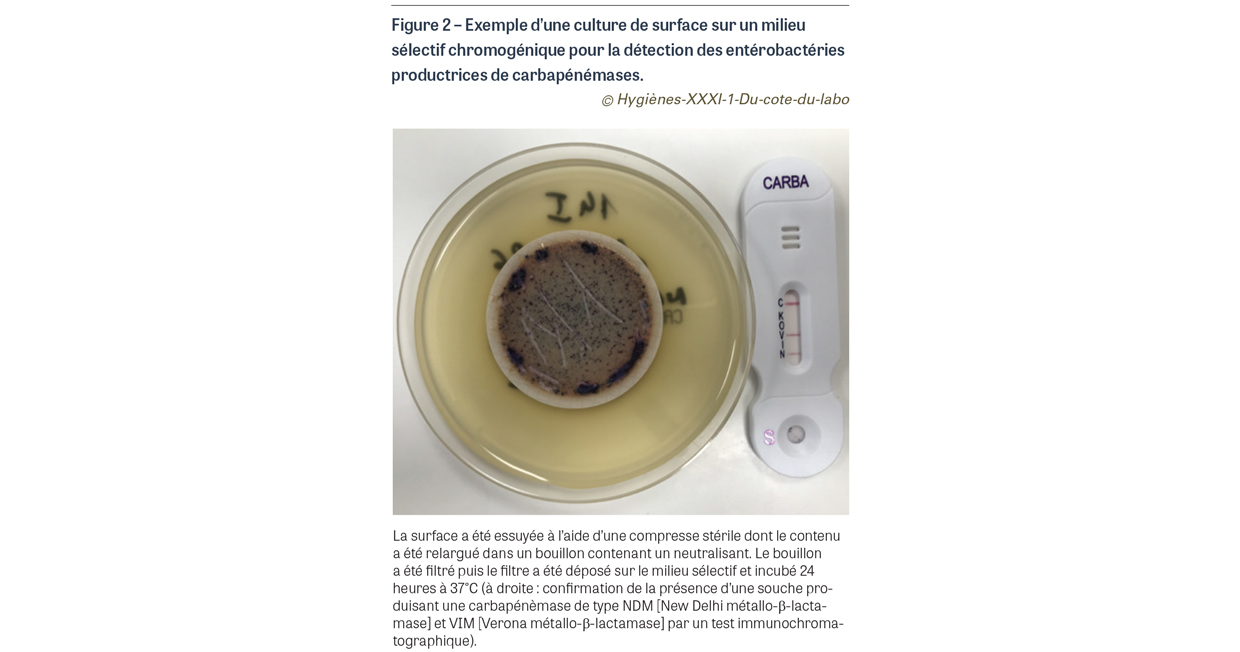
- il peut exister une flore bactérienne ou fongique interférente qui va perturber la culture du micro-organisme ciblé : l’utilisation de milieux de culture sélectifs est intéressante mais ils ne sont pas toujours disponibles sous une forme adaptée aux prélèvements de surface. Une des solutions possibles est d’utiliser des compresses stériles humidifiées pour prélever notamment les surfaces complexes, puis de les introduire dans un récipient stérile contenant de la solution utilisée pour le prélèvement des endoscopes (solution qui contient un neutralisant pour les traces de désinfectants). Après un passage à l’agitateur ou aux ultrasons, la suspension est filtrée. Le filtre peut ensuite être déposé sur n’importe quel milieu sélectif (milieu pour la recherche de bactéries hautement résistantes et émergentes [BHRe] par exemple) et incubé. Cette méthode permet également une quantification des cultures (Figure 2) ;
- seules les bactéries capables de se multiplier vont pouvoir être identifiées. Au sein d’un biofilm, les micro-organismes perdurent dans un état de dormance et ne sont pas toujours détectables par culture.
Détection génomique
La détection génomique est basée sur la mise en évidence du pathogène par détection moléculaire de son matériel génétique après extraction des acides nucléiques et amplification d’une séquence cible par PCR3 ou technique apparentée. C’est la seule méthode facilement utilisable pour la détection de virus.
Interprétation
La difficulté de l’interprétation des résultats dépend de plusieurs facteurs.
Un résultat qualitatif positif (présence du micro-organisme recherché) est en général simple à interpréter, sauf si l’on suspecte une contamination du prélèvement au cours de sa prise en charge technique. Des contrôles négatifs adaptés traités en même temps que les prélèvements à tester permettent d’éliminer ce risque.
Un résultat qualitatif négatif pose la question d’interférences lors des différentes étapes de l’analyse : qualité du prélèvement, défaut de relargage ou d’extraction, inhibition de la culture ou de l’amplification. Des contrôles positifs adéquats doivent être utilisés pour éviter ces écueils.
Les résultats quantitatifs sont encore davantage sujets à des variations analytiques, ce qui doit rendre leur interprétation très prudente. Concernant les virus, en cas de charge faible, se pose la question de la dose minimale infectante, d’autant que la présence de génome viral n’est pas synonyme de virus infectieux (par exemple un échantillon traité par des rayons ultraviolets reste assez fortement positif en technique génomique alors que le virus a perdu son pouvoir infectieux en culture cellulaire), et que de nombreux virus ne se cultivent pas sur des cellules (virus de l’immunodéficience humaine, virus des hépatites, papillomavirus…).
Exemples de prélèvements de surface à la recherche d’agents pathogènes
Bactéries
En routine, la surveillance de la qualité microbiologique de l’environnement de soins n’est pas recommandée. Toutefois, dans les zones à environnement maîtrisé, tel que les blocs opératoires ou les unités de thérapie cellulaire par exemple, la recherche de bactéries sur les surfaces est recommandée lors de la qualification des locaux, ou en cas de réalisation de travaux pouvant avoir un impact sur leur qualité microbiologique [14]. En cas de survenue de phénomènes épidémiques bactériens, une recherche spécifique des bactéries impliquées peut être envisagée, après analyse des causes et en cas de suspicion de la présence d’un réservoir environnemental. C’est par exemple le cas lors d’épidémies à BHRe [15]. Plusieurs équipes ont ainsi mis en évidence la colonisation persistante de siphons de douche par des souches d’entérobactéries productrices de carbapénémases [16,17]. La recherche de telles bactéries dans l’environnement de soins nécessite l’utilisation de milieux de culture sélectifs de l’espèce bactérienne résistante aux antibiotiques. Une détection directe du fragment de génome bactérien porteur de la mutation de résistance peut également être effectuée, sans mise en culture préalable. La présence du gène porteur de la résistance dans l’échantillon ne signifie pas pour autant que la bactérie résistante impliquée dans l’épidémie soit viable dans l’échantillon. L’implication indiscutable des surfaces de soins en tant que réservoir ou relais d’une épidémie d’infections à BHRe ne peut être affirmée que par la mise en évidence de la BHRe en culture, sous réserve qu’elle présente le même profil de résistance porté par le même support génétique (chromosome ou plasmide). Ces analyses ne sont pas réalisées en routine et font appel à des laboratoires spécialisés.
Champignons
La recherche de champignon filamenteux et notamment d’Aspergillus spp. dans l’environnement peut être réalisée lors de l’investigation de cas nosocomiaux d’infections fongiques. Le caractère fortement polymorphe de la contamination fongique environnementale, c’est-à-dire la présence dans l’environnement de très nombreuses souches d’origines génétiques différentes, rend l’identification sur des prélèvements de surface de la souche responsable de l’infection très peu probable, sans que le rôle de la contamination environnementale soit remis en cause [18].
Virus
Dans un contexte d’émergence d’infections virales, comme récemment avec le SARS-CoV-24 et le virus Mpox (MPXV), rechercher la présence de virus sur les surfaces de soins peut présenter un intérêt pour évaluer le risque de transmission indirecte par contact avec l’environnement [19]. Selon la méthodologie d’analyse utilisée, l’implication de l’environnement dans la transmission du virus est néanmoins difficile à évaluer.
SARS-CoV-2
Bien que le SARS-CoV-2 soit relativement facile à cultiver sur des cellules, à l’opposé d’autres coronavirus, cette technique nécessite l’utilisation d’un laboratoire de confinement de niveau 3 et l’obtention de résultats positifs peut prendre de quelques jours à plusieurs semaines, d’autant que les charges virales sont souvent beaucoup plus faibles sur les surfaces inertes que chez un être vivant capable de fournir le matériel cellulaire permettant la réplication virale. C’est pourquoi la détection de SARS-CoV-2 dans l’environnement, et notamment sur les surfaces, s’est faite essentiellement par techniques génomiques. Comme mentionné précédemment, ces techniques ont le grand inconvénient de ne pouvoir prédire l’infectiosité du matériel détecté donc sa transmissibilité à d’autres individus. Beaucoup de littérature a été publiée sur le risque infectieux représenté par les fomites (particules physiques porteuses de virus infectieux présentes dans l’environnement), mais très peu de ces écrits ont permis de démontrer un rôle majeur des surfaces contaminées dans l’épidémiologie du SARS-CoV-2 en dehors de contaminations immédiates par les interrupteurs, les poignées de portes ou les barres de soutien dans les transports en commun. Une méta-analyse très informative sur le sujet montre que le principal facteur de transmission est une exposition très prolongée (au moins douze heures) à un environnement très contaminé comme celui d’un patient au pic de l’infectiosité ; en revanche, la contamination dans d’autres lieux de vie paraît jouer un rôle très négligeable dans la transmission virale [20]. La durée de vie limitée des virus enveloppés dans l’environnement explique en grande partie cet impact modéré des surfaces dans la transmission du SARS-CoV-2.
MPXV
Le MPXV est un virus dont la transmission principale se fait par contact direct avec les lésions cutanées. Toutefois, la présence de virus au niveau de la peau lésée des personnes infectées laisse présager une contamination des surfaces de proximité, donc un risque de transmission indirecte par contact avec des objets contaminés. Si plusieurs études montrent la présence d’ADN5 du MPXV en quantité généralement faible dans l’environnement proche de patients infectés, sa capacité réplicative est rarement prouvée par culture cellulaire [21,22,23]. Le rôle des surfaces de soins en tant que relais de transmission indirecte de MPXV ne peut donc être exclu, mais les pratiques de routine de désinfection de l’environnement et d’hygiène des mains en accord avec les précautions standard en hygiène sont efficaces pour maîtriser ce risque de transmission au sein des structures de soins [24]. Au domicile des patients, cette voie de transmission pourrait présenter un risque moins théorique, comme l’illustre le cas de ces deux infirmières contaminées lors d’un prélèvement à domicile chez un patient atteint de Mpox au Brésil [25].
Utilité des prélèvements de surface
Intérêt pour le biologiste
Le biologiste dispose le plus souvent des outils de diagnostic de biologie humaine qu’il peut utiliser dans un contexte d’évaluation de la contamination des surfaces (cultures, PCR…). Il doit néanmoins intégrer dans son interprétation l’étape de prélèvement qui influe significativement sur le résultat de la recherche. La standardisation souvent difficile de cette étape ne permet pas une quantification précise ni un suivi dans le temps des résultats obtenus. Devant la relative simplicité de la méthode, le biologiste est donc amené à faire face à des difficultés d’interprétation et à une multiplication des demandes.
Intérêt pour le clinicien
L’environnement peut être impliqué dans la survenue d’infections associées aux soins et d’épidémies, et l’hygiène environnementale est essentielle pour la prévention du risque infectieux [26,27]. La réalisation de prélèvements de surface dans un service de soins permet d’évaluer la qualité microbiologique de l’environnement de prise en charge des patients. Même si les prélèvements de surface ne sont pas recommandés en routine, leur utilisation peut être envisagée en cas d’évaluation des pratiques d’hygiène environnementale dans le cadre de la formation des agents au bionettoyage ou de la mise en place d’un nouveau protocole de bionettoyage, dans un but pédagogique pour sensibiliser les personnels de soin au risque de transmission environnementale ou en complément d’un audit des pratiques, ou dans un contexte épidémique afin d’identifier des surfaces réservoir ou relais de phénomènes épidémiques.
Intérêt pour le patient
La maîtrise de la qualité microbiologique de l’environnement est un des maillons de la sécurité des soins. L’hygiène environnementale fait partie des précautions standard en hygiène hospitalière, qui doivent être respectées par tous les personnels de soins pour toute prise en charge de patient [28]. L’utilisation des prélèvements de surface, conjointement avec l’évaluation des pratiques de bionettoyage, peut permettre de garantir que les patients sont pris en charge dans un environnement de soins sûr.
Impact pour l’hygiéniste
Aujourd’hui
La recherche spécifique de micro-organismes sur des surfaces peut paraître simple mais ses performances sont très dépendantes de nombreux facteurs. Un résultat positif est intéressant et facile à interpréter. Un résultat négatif doit être appréhendé avec beaucoup de réserves, comme toute tentative d’évaluation et de suivi quantitatif. L’hygiéniste doit être pleinement conscient de ces limites : il peut se faire « piéger » par un résultat faussement négatif qui le détournera d’une authentique voie de transmission ou le mettra en défaut vis-à-vis des équipes soignantes du service concerné. L’identification d’un réservoir secondaire doit entraîner une action curative. La contamination persistante d’une surface peut nécessiter des interventions lourdes et coûteuses dont l’efficacité est parfois transitoire (exemple de la contamination des siphons de douche ou de lavabo, des toilettes et plus généralement des circuits d’élimination des eaux usées). Comme pour chaque prélèvement, il est nécessaire d’anticiper les actions correctives avant de les réaliser.
Demain
Le développement des techniques de séquençage de nouvelle génération, qui permettent de séquencer sans a priori toute présence d’acide nucléique dans un prélèvement et de l’identifier, peut également s’appliquer aux surfaces [29]. Cette approche métagénomique permet de disposer de données quasi exhaustives sur la présence de bactéries, de virus et d’autres micro-organismes, qu’ils puissent être cultivés ou pas. Bien qu’aujourd’hui limitée du fait de difficultés bio-informatiques non encore maîtrisées d’interprétation et d’identification fine des micro-organismes présents, elle permettra à terme de disposer de données considérables, incluant de surcroît la présence de gènes de résistance ou de virulence.
Conclusion
Le rôle des surfaces comme réservoir secondaire de micro-organismes reste à quantifier selon les différents agents infectieux. Néanmoins, la place du bionettoyage reste fondamentale pour la maîtrise de ce risque de transmission au même titre que l’hygiène des mains. Dans certains contextes d’échec de ces deux approches, ou lorsque les modes de transmission d’un nouvel agent infectieux sont méconnus, les prélèvements de surface peuvent avoir un intérêt. L’approche historique par culture et celle plus récente par détection du matériel génétique présentent chacune des avantages et des inconvénients qu’il est important de prendre en compte. Leur réalisation doit être standardisée autant que faire se peut, surtout si un suivi longitudinal quantitatif est souhaité. L’interprétation des résultats est complexe, au-delà d’une simple positivité qualitative. La signification d’un prélèvement négatif ou la quantification d’un prélèvement positif restent sujettes à de nombreux biais dont l’ensemble des acteurs doivent être conscients. Par ailleurs, la transmission indirecte par les surfaces ne doit pas détourner l’attention des équipes d’hygiène et celle des soignants de la première cause de transmission croisée : la transmission manuportée directe par défaut d’hygiène des mains.
Notes :
1- Coronavirus disease 2019, maladie à coronavirus 2019.
2- Voir Hygiènes 2022;30(6);373-381.
3- Polymerase chain reaction, réaction en chaîne par polymérase.
4- Severe acute respiratory syndrome coronavirus 2, coronavirus 2 du syndrome respiratoire aigu sévère.
5- Acide désoxyribonucléique.