Introduction
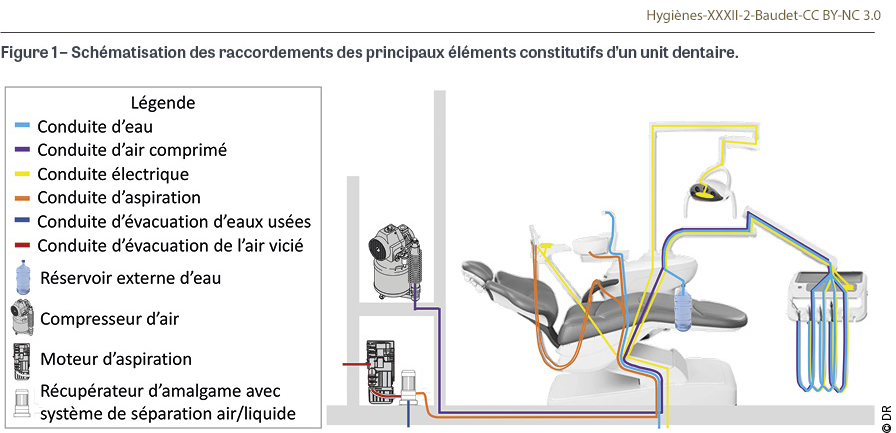
Dans son guide de bonnes pratiques de traitement des dispositifs médicaux réutilisables de 2022, la Société française d’hygiène hospitalière (SF2H) souligne que « l’entretien des units dentaires représente un challenge du fait de leur architecture interne complexe et de leur fragilité » [1]. Les units dentaires sont généralement connectés à un fauteuil de soins dentaires, et ce sont effectivement des dispositifs médicaux complexes car ils comprennent un ensemble d’éléments qui sont nécessaires à la dispensation des soins dentaires : de l’eau pour rincer et refroidir l’instrumentation dynamique (fraises et inserts ultrasonores) ; de l’air comprimé pour sécher avec la seringue d’air et faire tourner les fraises avec la turbine ; de l’électricité pour faire fonctionner l’ensemble des équipements de l’unit, le fauteuil et l’éclairage opératoire (scialytique) ; des commandes à main ou au pied pour contrôler l’instrumentation et le fauteuil dentaire ; un ou plusieurs plans de travail ou supports de plateaux pour déposer le matériel et les dispositifs médicaux nécessaires à la réalisation des soins ; une source d’aspiration pour évacuer l’eau, la salive, le sang, voire le pus et les résidus générés par les soins, mais aussi pour capter les aérosols générés par les porte-instruments dynamiques ; éventuellement un crachoir [2]. Pour fournir ces commodités, les units dentaires sont raccordés à un système d’alimentation en eau (généralement de l’eau du réseau en direct ou par le biais d’un réservoir interne ou externe), à un système d’alimentation en air (compresseur d’air ou réseau centralisé d’air comprimé), à une alimentation électrique, à un moteur d’aspiration connecté à un séparateur d’amalgame pour éviter le rejet de mercure dans l’environnement, et à un système d’évacuation des eaux usées [3] (Figure 1). Les units dentaires présentent aussi des fragilités notamment au niveau des conduites d’eau et d’aspiration. Au centre hospitalier régional universitaire (CHRU) de Nancy, lors de tests de différentes solutions de traitement des conduites d’eau des units, réalisés il y a une dizaine d’années, une corrosion d’éléments en laiton avait été relevée, nécessitant le changement des valves et des tubulures des units. Dans un hôpital irlandais, il a été montré que le système de fixation des tuyaux d’aspiration sur les units dentaires pouvait se corroder avec le temps [4]. Dans un hôpital chinois, il a été montré que des produits de désinfection des aspirations pouvaient engendrer une corrosion plus ou moins importante des raccords des conduites [5]. Le choix de solutions détergentes et désinfectantes destinées au traitement des conduites et des surfaces des units dentaires doit donc prendre en compte l’efficacité mais aussi l’innocuité des produits. Le bon entretien des units dentaires est capital afin de prévenir la survenue d’infections associées aux soins mais aussi pour maintenir leur bon fonctionnement, éviter les pannes, et assurer leur longévité. L’objectif de cet article est de décrire les risques de contamination des units dentaires ainsi que les modalités d’entretien des différents éléments constitutifs pour garantir la sécurité des soins.
Risques de contamination
Eau
De nombreuses études ont montré que l’eau de sortie des units dentaires était régulièrement contaminée par des bactéries en concentration supérieure aux niveaux recommandés (inférieure à 100 ou 200 unités formant colonie [UFC] par millilitre de flore totale selon les pays). De plus, les analyses d’eau issue des units dentaires ont montré que l’on pouvait retrouver des bactéries pathogènes opportunistes telles que Legionella pneumophila, Pseudomonas aeruginosa, Mycobacterium spp., Bacillus cereus, voire des champignons tels que Candida spp. [6,7,8,9,10,11,12,13,14,15]. Cette contamination fréquente de l’eau de sortie des units dentaires trouve plusieurs explications. Tout d’abord, l’eau d’alimentation de l’unit peut être une source de contamination [11,13], notamment si l’unit est directement raccordé à l’eau du réseau et qu’il n’est pas pourvu d’un réservoir permettant de traiter cette eau [7,9,16]. Ensuite, une rétro-contamination de l’eau de l’unit par des fluides oraux issus du patient est possible depuis les porte-instruments dynamiques en raison d’une efficacité insuffisante des dispositifs anti-reflux [9,10,15]. Enfin, l’eau peut se charger en bactéries lorsqu’elle circule dans les conduites d’eau de l’unit dentaire car ces conduites représentent un environnement favorable au développement de biofilms bactériens pour plusieurs raisons : elles constituent un réseau long et complexe avec de multiples connexions et des conduites de faible diamètre générant une vitesse d’écoulement de l’eau quasi-nulle au contact des parois internes de ces conduites [17] ; ces conduites sont en plastique, matériau propice au développement bactérien [18] ; l’eau stagne dans les conduites en raison des nombreuses périodes d’inactivité de l’unit, ce qui facilite la croissance du biofilm. Les risques associés à la contamination de l’eau des units sont réels car, lors des soins dentaires, cette eau entre directement en contact avec le patient au niveau de ses muqueuses buccales, de sa peau par projection, mais aussi de son système vasculaire, voire de l’os des mâchoires lors des activités de chirurgie dentaire. Elle peut aussi être ingérée et inhalée par les patients sous forme d’aérosols produits par les porte-instruments dynamiques. Les chirurgiens-dentistes et assistants dentaires y sont eux aussi exposés par projection cutanéo-muqueuse et inhalation d’aérosols. Plusieurs cas d’infections associées aux soins liées à l’eau d’units dentaires contaminés ont été rapportés dans la littérature. Deux séries d’infections à mycobactéries non tuberculeuses, notamment Mycobacterium abcessus, ont été rapportées dans deux cliniques dentaires pédiatriques aux États-Unis entre 2013 et 2016 et ont concerné respectivement 24 enfants (14 cas confirmés et 10 cas suspectés) et 71 enfants (22 cas confirmés et 49 cas suspectés) qui ont dû être hospitalisés [19,20]. Deux autres cas d’infection à mycobactérie non tuberculeuse (M. fortuitum et M. abscessus) ont été rapportés en Amérique latine en lien avec une contamination de l’eau des units utilisés lors d’extractions dentaires chez deux patientes de 18 et 21 ans en bonne santé [21]. Enfin, deux cas d’infection à L. pneumophila sérogroupe 1 provenant de l’eau des units de leurs chirurgiens-dentistes ont conduit au décès de patients : une femme de 82 ans en 2011 en Italie [22] et un homme âgé immunodéprimé en 2012 en Suède [23].
Surfaces
D’une manière générale, les surfaces au sein des salles de soins de cabinets dentaires français sont assez faiblement contaminées par les micro-organismes, probablement en raison de l’entretien fréquent des surfaces [24]. Au niveau des units dentaires, il a été montré une contamination sur les plateaux et sur les boutons de commande allant jusqu’à 4 UFC/cm2 dans 6 cliniques dentaires italiennes au cours de la journée [25], et avec une augmentation de la contamination médiane de ces surfaces au cours de la journée passant de 0,3 à 0,6 UFC/cm2 entre avant et après l’activité clinique dans 10 hôpitaux italiens [12]. Roberts et al. ont montré que, sur 19 fauteuils dentaires prélevés dans 7 cliniques américaines, 2 (10,5%) présentaient une contamination à Staphylococcus aureus résistant à la méticilline (SARM) après la prise en charge de patients et avant le bionettoyage [26]. Kurita et al. ont pu montrer que l’unit dentaire au sein de leur hôpital japonais était lui aussi contaminé par des SARM avec des souches retrouvées au niveau de la seringue air-eau de l’unit et de l’accoudoir du fauteuil dentaire en raison d’un bionettoyage insuffisant [27]. Il est évident que, lors des soins, les surfaces de l’unit et du fauteuil dentaires sont contaminées à la fois par contact avec le patient et avec les gants souillés du chirurgien-dentiste et de son assistant, et par la projection de gouttelettes issues de la bouche du patient et par voie aérienne via les bioaérosols émis par les porte-instruments dynamiques. Ainsi, les surfaces de l’unit et du fauteuil dentaires sont contaminées par des micro-organismes de la flore commensale cutanée et orale, voire par des bactéries pathogènes, des virus et des champignons. Ces contaminations environnementales peuvent être source de contamination croisée par contact direct ou indirect via les mains si les surfaces sont insuffisamment désinfectées.
Système d’aspiration
Le système d’aspiration est particulièrement exposé aux contaminations microbiologiques puisqu’il est exposé aux liquides biologiques aspirés en bouche (salive, sang, pus…). Il peut ainsi être observé la présence de biofilms de couleur noirâtre dans les tuyaux d’aspiration après quelques années d’utilisation [28]. De nombreuses bactéries sont retrouvées sur la partie interne des tuyaux des systèmes d’aspiration avec principalement des bactéries commensales de la cavité orale et des bactéries environnementales, incluant des bactéries pathogènes tels que Staphylococcus aureus, Pseudomonas aeruginosa, Pseudomonas putida, Serratia marcescens et Stenotrophomonas maltophilia [4,29-31]. Le risque serait négligeable si le flux d’aspiration n’allait que dans le sens prévu, c’est-à-dire de la bouche vers le moteur d’aspiration. Or quelques anciennes études ont montré qu’un bref reflux (<0,1 s) était possible lorsque l’embout d’aspiration était plaqué contre une muqueuse [31] ou lorsqu’un patient fermait ses lèvres autour de la canule d’une pompe à salive [32,33]. Il a été montré que chaque reflux d’aspiration comprenait de 1 à 300 UFC (25 UFC en moyenne) avec principalement des streptocoques, des microcoques et des bacilles à Gram négatif non fermentants [31]. Ainsi, le risque de contamination croisée ne peut être écarté et l’entretien adéquat du système d’aspiration est exigé pour lutter contre la contamination des différents éléments qui le composent. Le bon entretien du système d’aspiration est aussi primordial pour maintenir la performance de l’aspiration, qui contribue elle aussi à la prévention du risque infectieux. En effet, un système d’aspiration performant permet de capter les aérosols à la source et ainsi de lutter contre la dissémination des aérosols produits par les porte-instruments dynamiques dans la salle de soins dentaires [34].
Air comprimé
Très peu d’études se sont intéressées à l’air comprimé alimentant les units dentaires. Dans une clinique dentaire américaine, il a été montré que l’air de la salle alimentant le compresseur était fortement chargé en bactéries (19 à 57 fois plus que dans l’air extérieur), ce qui s’expliquait par le fait que l’air du système d’aspiration était recraché dans cette même salle. Par conséquent, l’air humide et chaud en sortie de compresseur était fortement chargé en micro-organismes (>30 000 UFC/m3). Toutefois, après passage dans le dessiccateur d’air, l’air comprimé à l’entrée des units dentaires était faiblement contaminé (<50 UFC/m3) avec une concentration bactérienne inférieure à celle retrouvée dans l’air ambiant de la salle de soins [35]. Dans un autre centre dentaire américain, il a été montré que l’air comprimé issu de 30 secondes d’utilisation de la seringue d’air de 10 units comprenait des bactéries dans seulement 45% des prélèvements faits le matin et en faible quantité (<5 UFC dans la majorité des prélèvements positifs). De plus, plus aucune bactérie n’était détectée dans les prélèvements faits l’après-midi après utilisation de ces mêmes units [36]. Les rares études menées sur l’air comprimé des units dentaires semblent indiquer que le risque de contamination de l’air au niveau de l’unit est faible, d’autant plus si le compresseur est équipé d’un dessiccateur d’air et que l’air comprimé a été renouvelé dans les conduites au cours de la journée.
Prévention du risque infectieux
Maîtrise et contrôle de la qualité microbiologique de l’eau
À l’achat, il faut opter pour un unit dentaire qui permet l’utilisation d’une solution chimique de traitement de l’eau. Pour ce faire, l’unit dentaire doit posséder un réservoir interne ou, mieux, un réservoir amovible externe (de type bouteille). Les avantages des réservoirs amovibles externes sont qu’ils peuvent être désinfectés périodiquement par trempage dans une solution détergente désinfectante ou par passage en laveur désinfecteur, qu’ils permettent de filtrer leur eau d’alimentation avec un filtre microbiologique de 0,22 µm installé sur un robinet, et qu’il est possible d’utiliser la solution de traitement de l’eau que l’on souhaite alors que certaines marques d’units dentaires avec réservoir interne rendent les utilisateurs captifs de leur solution de traitement. De plus, il est recommandé de choisir un unit dentaire avec des valves anti-reflux et des joints anti-retour au niveau de ses tubulures afin d’éviter le reflux de liquide de la cavité buccale du patient dans les conduites d’eau de l’unit lors des soins. À l’installation, un traitement chimique initial (chocage) doit être effectué pour retirer le biofilm qui s’est formé suite à la fabrication et à l’assemblage de l’unit dentaire. Plusieurs solutions de traitement initial sont disponibles sur le marché telles que le BRS® d’Alpro médical (St. Georgen im Schwarzwald, Allemagne) et l’ICX Renew® d’A-dec (Newberg, OR, États-Unis) dont l’efficacité a été démontrée pour respectivement 100% et 76% des units dentaires traités au CHRU de Nancy [37,38,39]. D’autres solutions de traitement initial existent mais n’ont, à notre connaissance, pas fait l’objet de publication pour évaluer leur efficacité. Après la réalisation du chocage et avant de mettre en fonction l’unit dentaire, il est conseillé d’effectuer une analyse microbiologique de l’eau de sortie de l’unit pour s’assurer de la bonne décontamination de ses conduites d’eau [39,40]. En utilisation, la bonne qualité microbiologique de l’eau doit être maintenue en utilisant une ou plusieurs solutions chimiques de traitement associées à des moyens physiques [41,42]. S’agissant des moyens physiques, outre la filtration de l’eau d’alimentation et les systèmes anti-reflux abordés précédemment, il convient de réaliser une purge de toutes les conduites d’eau de l’unit durant au moins 30 secondes chaque matin afin d’éliminer les micro-organismes ayant pu proliférer dans l’eau qui a stagné toute la nuit, mais aussi après chaque patient afin de lutter contre la rétro contamination des conduites utilisées et la stagnation de l’eau dans les conduites inutilisées [41,43]. Réaliser une purge permet d’abaisser le niveau de contamination de l’eau de sortie des units, toutefois ce n’est pas un moyen suffisant pour maîtriser la qualité microbiologique de l’eau [8]. Un traitement chimique de l’eau doit compléter ces moyens physiques. Pour cela, de nombreuses solutions existent sur le marché. En France, les solutions de traitement de l’eau des units les plus utilisées sont le Calbenium® d’Airel-Quetin (Champigny-sur-Marne, France), le Dentosept® de Dentsply Sirona (Charlotte, NC, États-Unis), l’Oxygenal™ de KaVo (Biberach an der Riß, Allemagne), l’ICX® d’A-dec, le Sterispray® de Gamasonic (Billom, France) et l’Alpron™ et le Bilpron™ d’Alpro Medical [44]. Il apparaît que les traitements en continu (produit chimique dilué dans l’eau utilisée pour les soins) offrent de meilleurs résultats que les traitements intermittents ou périodiques (produit chimique utilisé en dehors des périodes de soins) [37,45]. S’agissant des traitements en continu, le Calbenium® semble avoir offert d’assez bons résultats aux Hôpitaux universitaires de Strasbourg, tout comme le Sterispray® et l’Hygowater® de Dürr Dental (Bietigheim-Bissingen, Allemagne) [46,47], alors que l’efficacité du Calbenium® s’est avérée insuffisante au CHU de Poitiers et dans un hôpital italien, tout comme l’Oxygenal™ et l’ICX® [45,48]. Il est aussi possible d’associer un traitement en continu bactériostatique à un traitement périodique bactéricide. Le fait d’associer deux solutions différentes de traitement semble offrir les meilleurs résultats pour maîtriser la qualité microbiologique de l’eau des units [7]. Par exemple, l’association d’Alpron™ (utilisé dilué en continu) et de Bilpron™ (utilisé pur pendant les week-ends et les périodes de congés) a donné de très bons résultats sur le long terme au CHRU de Nancy [38]. Afin de s’assurer que les moyens de maîtrise de la qualité microbiologique de l’eau sont efficaces, des contrôles doivent être effectués périodiquement en prélevant de l’eau issue de toutes les conduites d’eau des units. Au CHRU de Nancy, après une phase de test de plusieurs solutions de traitement où des prélèvements étaient effectués toutes les semaines durant un mois, les prélèvements se sont ensuite progressivement espacés pour n’être réalisés plus qu’une fois tous les six mois [37]. Après plusieurs années de résultats satisfaisants [38], les prélèvements sont maintenant effectués une fois par an. Cette périodicité annuelle de prélèvement devrait être retenue dans les prochaines recommandations portées par l’Association dentaire française. Les analyses microbiologiques de l’eau prélevée doivent cibler une qualité d’eau pour soins standards définie par le guide technique de l’eau dans les établissements de santé [49], ainsi qu’une absence de détection de Legionella pneumophila (Tableau I). En présence de pathogènes ou d’une flore totale excédant dix fois le niveau cible, un chocage des conduites d’eau de l’unit dentaire est recommandé, suivi d’un nouveau prélèvement pour confirmer la maîtrise de la contamination avant de pouvoir réutiliser l’unit pour prendre en soin des patients.
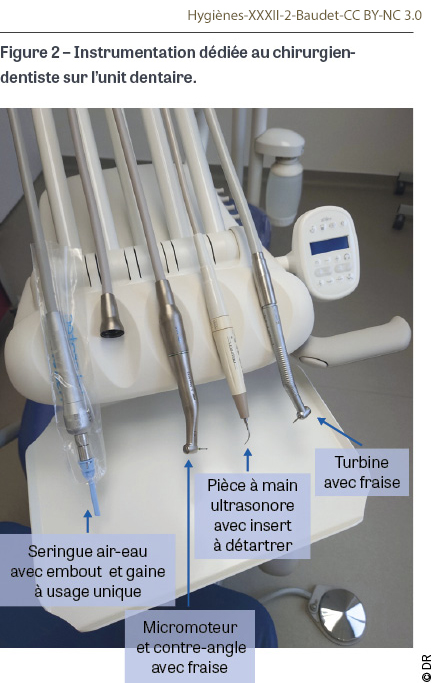
Entretien des surfaces
À l’achat, il est recommandé de s’orienter vers des équipements faciles à nettoyer, avec notamment un fauteuil lisse et sans couture, des cordons et des surfaces lisses, et des commandes par touches digitales sans relief [41]. Lors des soins, les souillures doivent être essuyées le plus rapidement possible et avant qu’elles ne sèchent au moyen d’une lingette ou d’une lavette imprégnée de produit détergent désinfectant [41]. Après la prise en charge de chaque patient, l’unit et le fauteuil dentaires doivent recevoir un traitement de bas niveau car ce sont des dispositifs médicaux non critiques [1,41]. Ce traitement est classiquement fait en un seul temps par essuyage avec un produit détergent désinfectant en utilisant soit une lingette à usage unique pré-imprégnée de produit détergent désinfectant, soit un support non tissé à usage unique (type essuie-main) imprégné d’un détergent désinfectant en spray, soit une lavette textile de préférence en microfibres que l’on trempe dans une solution détergente désinfectante préalablement préparée dans un bac. La lavette est changée pour chaque patient mais réutilisable après lavage en machine (>60°C) ; elle ne doit pas être retrempée après avoir essuyé une surface pour ne pas contaminer la solution. L’entretien des surfaces externes s’effectue du haut vers le bas et du propre vers le sale [50]. Les désinfectants doivent a minima répondre aux normes de phase 2, étapes 1 et 2 en conditions de saleté pour la bactéricidie (NF EN 13727 et NF EN 16615), la levuricidie (NF EN 13624 testé sur Candida albicans et NF EN 16615) et la virucidie (NF EN 14476+A2 et NF EN 17111 sur virus enveloppés) [1]. Ils doivent être utilisés selon les préconisations du fabricant : concentration, temps d’action, durée de conservation et utilisation d’équipements de protection individuelle (gants à usage unique, voire masque à usage médical, lunettes de protection et tablier à usage unique) pour se protéger des risques microbiologiques et chimiques [42]. Au niveau de l’instrumentation utilisée par le praticien (Figure 2), la seringue air-eau est idéalement associée à un embout et à une gaine de protection à usage unique pour en simplifier l’entretien après chaque patient, qui comprend une purge de l’eau et l’essuyage des surfaces avec un détergent désinfectant. Par exemple, dans l’étude de Kurita et al. qui avait mis en évidence une contamination de la seringue air-eau par des SARM, la révision du protocole de désinfection avec l’utilisation de gaines à usage unique avait permis de faire cesser les contaminations [27]. S’agissant des porte-instruments dynamiques (pièces à main rotatives et ultrasonores, contre-angles et turbines) clipsés sur les cordons de l’unit, ce sont des dispositifs médicaux qui entrent en contact avec les muqueuses orales et qui sont exposés aux liquides biologiques. Ils doivent être purgés avec les conduites d’eau et changés après chaque patient pour suivre un cycle de stérilisation comprenant un passage en automate dédié ou en laveur désinfecteur équipé d’une rampe spécifique [51].
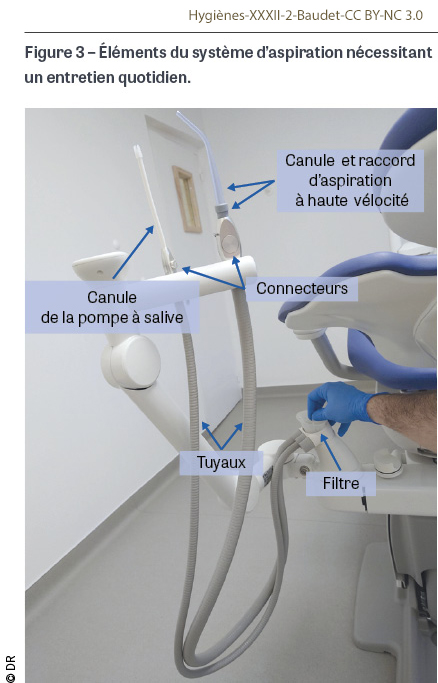
Entretien du système d’aspiration et du crachoir
À l’achat, il est recommandé d’opter pour un fauteuil sans crachoir, qui est jugé peu hygiénique et dont on peut s’affranchir avec l’utilisation des aspirations. Il peut aussi être préféré un unit dentaire disposant d’un système de rinçage automatisé du système d’aspiration afin d’éviter la coagulation du sang et la fixation de dépôts dans les conduites d’aspiration. À l’installation, un nettoyage et une désinfection initiaux du système d’aspiration sont requis car il a été montré que des tuyaux neufs présentaient déjà des contaminations microbiologiques probablement liées au transport et à leur manipulation [28].
Entretien quotidien
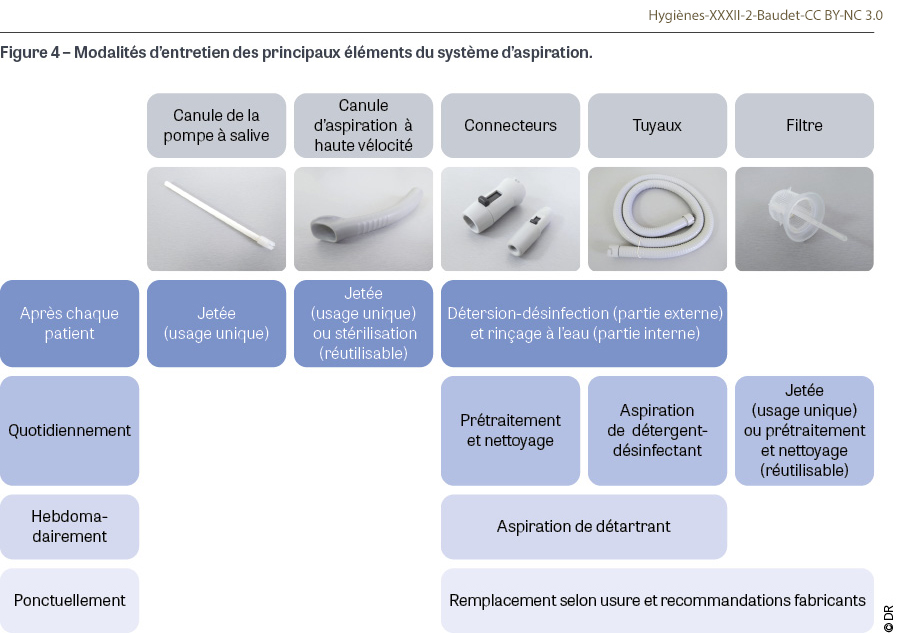
Lors d’une journée de travail, les différents éléments du système d’aspiration de l’unit (Figure 3) subissent des entretiens particuliers [52] (Figure 4) :
- La canule de la pompe à salive à usage unique doit être éliminée après chaque patient. Ce changement est crucial car il a été montré qu’en cas de reflux du système d’aspiration, l’intérieur de la canule pouvait être contaminé (tout en évitant que le reflux liquidien n’atteigne la bouche du patient) [31].
- La canule et l’éventuel raccord de l’aspiration à haute vélocité (aspiration chirurgicale) sont soit à usage unique et jetés après chaque patient, soit réutilisables et dans ce cas suivent le cycle de stérilisation comprenant un écouvillonnage [51].
- Les connecteurs sont en métal ou en plastique, leurs surfaces internes doivent être rincées par aspiration d’eau après chaque patient, puis ils doivent être essuyés avec une lingette ou une lavette imprégnée de détergent désinfectant. De plus, ils peuvent être démontés quotidiennement en fin de journée pour suivre un prétraitement par trempage dans un bac de détergent désinfectant, puis être nettoyés et désinfectés soit manuellement au moyen d’une brosse et d’un écouvillon avec une solution détergente désinfectante, soit mécaniquement en laveur désinfecteur. L’intégrité de leurs joints doit être vérifiée après traitement, ils sont remplacés si nécessaire [50].
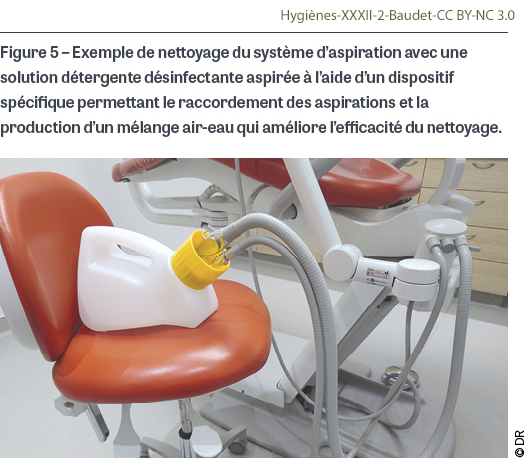
- Les tuyaux doivent être rincés par aspiration d’eau chaque matin (avec un à deux litres d’eau froide) et après chaque patient (avec un demi-litre à un litre d’eau froide). Ils doivent être nettoyés et désinfectés par aspiration d’une solution détergente désinfectante spécifique au moins une fois par jour en fin de journée selon les recommandations du fabricant et en utilisant un dispositif dédié (Figure 5). Un traitement détergent et détartrant complémentaire doit être effectué périodiquement (généralement une fois par semaine) selon les recommandations du fabricant. Les surfaces externes des tuyaux sont essuyées avec une lingette ou une lavette imprégnée de détergent désinfectant après chaque patient.
- Le filtre est soit à usage quotidien et doit donc être jeté chaque fin de journée, soit réutilisable et doit être nettoyé et désinfecté quotidiennement de manière manuelle avec une brosse et un bac de détergent désinfectant ou de manière automatisée en laveur désinfecteur à condition que le filtre soit thermorésistant. L’intégrité du filtre doit être contrôlée à chaque mise en place sur l’unit car, s’il est défectueux, des débris pourraient abîmer ou créer des bouchons dans les parties en aval.
- Si l’unit dentaire est équipé d’un crachoir, celui-ci doit être rincé à l’eau après chaque patient puis essuyé avec une lingette ou une lavette imprégnée de détergent désinfectant. Il est nettoyé, désinfecté et détartré de la même manière que les tuyaux d’aspiration.
Produits d’entretien
Il existe différents produits spécifiques pour l’entretien des systèmes d’aspiration et des crachoirs mais les études évaluant leur efficacité sont rares. Une étude menée aux Hôpitaux universitaires de Strasbourg a montré une bonne efficacité du nettoyage et de la désinfection par l’Orotol® de Dürr Dental utilisé chaque matin, chaque soir et entre chaque patient, associé au passage hebdomadaire de MD555 cleaner de Dürr Dental [28]. Au Dublin Dental University Hospital, l’aspiration d’un litre d’eau entre chaque patient associée à l’utilisation d’Orotol® plus de Dürr Dental ou de Green&Clean™ M2 de Metasys (Rum bei Innsbruck, Autriche) deux fois par jour (en fin de matinée et en fin d’après-midi) a donné des résultats beaucoup plus mitigés avec une contamination persistante de la majorité des units après leur désinfection tant au niveau des tuyaux de la pompe à salive et de l’aspiration haute vélocité que des filtres [30]. D’autres études sont donc requises pour évaluer les différents produits sur le marché et trouver la solution de traitement avec le protocole le plus efficace.
Évacuation des déchets solides et de l’air
Le récupérateur d’amalgames doit être vidé lorsque son collecteur est plein en fermant ce dernier de manière hermétique et définitive puis en installant un nouveau collecteur. La collecte des déchets mercuriels doit être effectuée périodiquement par une société spécialisée. L’air évacué par le système d’aspiration devra idéalement être envoyé à l’extérieur en dehors d’une zone de passage et à distance du captage d’air du compresseur dentaire. Dans le cas contraire, le système d’aspiration doit être équipé d’un filtre bactériologique d’échappement à changer une à deux fois par an selon les recommandations du fabricant [53,54,55].
Mesures pour assurer la qualité de l’air issu du compresseur dentaire
À l’achat, le compresseur dentaire doit comprendre un filtre permettant la filtration de l’air à l’entrée et un filtre bactériologique au niveau du système de dessiccation permettant de délivrer de l’air sec de « qualité médicale » [53,55]. La centrale d’air comprimé fournissant de l’air aux units dentaires doit répondre à la norme NF EN ISO 22052 [56]. À l’installation, le compresseur doit être placé dans un local non poussiéreux, sec, frais mais hors gel, disposant d’une ventilation efficace et à distance des rejets d’air vicié du système d’aspiration. L’air d’alimentation du compresseur est idéalement capté à l’extérieur et à distance de l’évacuation d’air vicié du système d’aspiration [35,57]. À l’usage, il semble intéressant d’activer la seringue d’air de l’unit chaque matin avant de commencer l’activité de soins de manière à renouveler l’air des conduites d’air comprimé pour évacuer les bactéries présentes [36]. Au niveau du compresseur, il faut changer ou stériliser les filtres selon la périodicité indiquée par le fabricant, généralement une fois par an [53].
Conclusion
Les units dentaires sont des dispositifs complexes qui présentent de multiples voies de contamination possibles. Pour garantir la sécurité des soins, leur entretien optimal requis au quotidien comprend : un traitement chimique de l’eau de l’unit associé à une purge des conduites d’eau de l’unit chaque matin et après chaque patient, ainsi qu’à un prélèvement de contrôle périodique de la qualité microbiologique de l’eau en sortie d’unit ; la désinfection avec un produit détergent désinfectant des surfaces de l’unit et du fauteuil dentaire après chaque patient ; un rinçage à l’eau du système d’aspiration après chaque patient, sa détersion désinfection au moins une fois par jour avec un produit dédié et le changement ou la détersion désinfection des éléments amovibles.