Introduction
La légionellose est une maladie infectieuse respiratoire due à une bactérie du genre Legionella [1]. Ces micro-organismes sont naturellement présents dans l’environnement, notamment dans les eaux douces et plus particulièrement dans les circuits d’eau chaude sanitaire (ECS) qui alimentent les bâtiments lorsque la température de l’eau varie entre 25°C et 43°C. La contamination se fait par inhalation d’un aérosol contenant des légionelles. Le risque est d’autant plus important que la concentration en légionelles est élevée [1]. La légionellose est une maladie à déclaration obligatoire. En 2021, 2 060 cas ont été notifiés en France [2]. Cette incidence annuelle de 3,0 cas pour 100 000 habitants augmente avec l’âge et le sexe, le taux d’incidence le plus élevé s’observant chez les hommes de plus de 80 ans (9,3 pour 100 000 habitants par an). Selon les études, la part des légionelloses au sein des pneumopathies aiguës communautaires varie de 5% chez les patients hospitalisés à 12% chez ceux pris en charge en soins critiques [3]. La létalité de la légionellose a été de 9% (172 décès) en 2021 [2]. Cette gravité relative est liée à plusieurs facteurs : la population concernée a souvent des facteurs de risques de gravité (cancer, hémopathie, diabète, prise de corticoïde ou d’immunosuppresseur…) ; les légionelles sont naturellement résistantes aux antibiotiques de première intention donnés pour les pneumopathies communautaires (les pénicillines et les céphalosporines) qui ciblent avant tout le pneumocoque, avec pour conséquence un retard à la mise en place d’un traitement efficace ; le diagnostic est essentiellement hospitalier donc seules les formes graves sont notifiées (en 2010 seulement 30 cas sur 2 060, soit 1,5%, n’avaient pas été hospitalisés) [2]. Les hôpitaux et les établissements hébergeant des personnes âgées dépendantes (Ehpad) représentaient respectivement 6% et 4% des lieux d’exposition identifiés. Malgré ces proportions relativement faibles, la gestion du risque infectieux lié aux légionelles est une mission importante de ces structures pour laquelle les équipes opérationnelles d’hygiène sont régulièrement sollicitées. Plusieurs textes réglementaires décrivent les obligations de ces établissements [4-8]. Avant la survenue de la pandémie de Covid-191, les agences régionales de santé (ARS) réalisaient des inspections régulières des établissements concernés, en plus de leurs interventions en cas de signalement de cas de légionellose nosocomiaux ou suspectés de l’être. De plus, la survenue de cas de légionellose peut constituer un sujet médiatique difficile à gérer. L’objectif de cet article est de décrire les modalités de la recherche des légionelles dans l’ECS et de préciser leur place au sein d’une politique globale de prévention du risque. Les légionelles peuvent également être recherchées dans l’eau froide, les eaux alimentaires, les tours aéroréfrigérantes, les eaux troubles ou les boues : ces analyses plus complexes ne seront pas développées dans cet article.
La recherche des légionelles dans l’eau chaude sanitaire : une analyse codifiée soumise à une accréditation spécifique
Depuis 2010 pour les Ehpad et 2012 pour les hôpitaux, les recherches de légionelles dans l’eau doivent être réalisées par un laboratoire accrédité pour que ces analyses soient reconnues par les autorités de tutelles (ARS) [7]. L’obtention de cette accréditation est une démarche volontaire et payante de la part du laboratoire, placée sous l’égide du Comité français d’accréditation2 (Cofrac). Elle est délivrée après la visite de plusieurs experts (expert technique, qualiticien) du Cofrac, si le laboratoire respecte l’ensemble des critères demandés. L’habilitation doit être renouvelée chaque année par une visite de membres du Cofrac. En cas d’écart identifié lors d’une visite d’inspection, l’accréditation peut être suspendue. Les laboratoires qui souhaitent se lancer dans cette démarche doivent pouvoir s’adosser à un système qualité robuste incluant la présence d’un référent en assurance qualité (RAQ) et d’un système performant de management de la qualité, notamment documentaire. Il s’agit donc d’une démarche volontaire très consommatrice de temps, d’argent et d’énergie qui, pour les laboratoires hospitaliers, s’additionne à l’accréditation réglementaire des laboratoires d’analyse médicale selon la norme ISO 15189. Le laboratoire accrédité pour la détection des légionelles dans l’ECS doit respecter plusieurs normes : la norme générale NF EN ISO/CEI 17025 (ou ISO 17025) qui est une norme internationale spécifiant les exigences de qualité et de compétence applicables aux laboratoires d’essai et d’étalonnage (elle précise notamment le système qualité qui doit encadrer la réalisation de l’analyse) [9] ; la norme technique NF T90-431 qui décrit très précisément comment la recherche de légionelles doit être réalisée [10] ; la norme FD T90-522 conformément à laquelle les prélèvements d’eau sont effectués par une personne formée aux techniques de prélèvement [11]. Les versions de ces normes évoluent avec le temps et les laboratoires ont en moyenne six mois pour implémenter une nouvelle version dans leur pratique quotidienne. N’importe quel laboratoire peut néanmoins réaliser des recherches de légionelles dans l’eau, en utilisant la norme technique mentionnée ci-dessus ou toute autre méthode. S’il n’est pas accrédité, ces recherches peuvent être utilisées en interne comme des « autocontrôles » mais n’ont aucune valeur en dehors de l’établissement. Historiquement un nombre minimal d’analyses devait être réalisé sous accréditation par établissement (deux analyses annuelles pour cent lits d’hospitalisation, et un minimum de dix analyses pour les structures de moins de cinq cents lits) [12]. Les textes réglementaires les plus récents ont fait disparaître ce nombre minimum de prélèvements au profit d’une surveillance globale du réseau [5].
Le prélèvement d’eau à la recherche de légionelles : un paramètre important de variabilité des résultats et donc de leur interprétation
Un réseau d’ECS comprend une source de production, un réseau « bouclé » qui revient à la source de production et des canalisations plus courtes branchées sur cette boucle afin d’alimenter des robinets et des douches (Figure 1). Ces derniers éléments constituent des « bras morts » au niveau desquels l’eau ne circule pas, sauf quand ces points d’eau sont utilisés. L’étape de prélèvement de l’ECS est un maillon particulièrement important de l’analyse ; elle a été récemment normalisée [11]. Les préleveurs doivent être habilités : ils bénéficient d’une formation théorique et pratique au cours de laquelle ils effectuent des prélèvements en parallèle de préleveurs déjà habilités et sont ensuite évalués par des tuteurs. Leur habilitation est ensuite maintenue sous condition de réalisation d’un nombre minimal de prélèvements et d’une réévaluation régulière.
La norme encadre strictement la réalisation des prélèvements, qui peuvent être de différentes natures :
- prélèvements au niveau des zones techniques (et notamment au niveau du retour de la boucle d’ECS) : ces zones de prélèvement ne sont utilisées que pour la recherche de légionelles, elles doivent donc être désinfectées et purgées abondamment avant d’être prélevées. Il faut néanmoins veiller à ce que la méthode de désinfection, chimique ou thermique, du point de ponction ne diminue pas artificiellement la quantité de légionelles présentes, ce qui nécessite une purge après l’étape de la désinfection avant de prélever. Il faut aussi s’assurer que le site de prélèvement sur le retour de boucle ne se situe pas sur un élément dérivé du réseau dans lequel l’eau stagne, ce qui augmenterait artificiellement la prolifération bactérienne ;
- prélèvements au niveau des points d’usage (douches et robinets), qui sont de plusieurs types : ils peuvent être effectués directement après ouverture du robinet ou de la douche, et sont alors dits « de premier jet » et correspondent à l’exposition du patient quand il prend sa douche par exemple. Pour qu’ils soient représentatifs de ce risque, il ne faut pas que le point d’eau ait été utilisé avant le prélèvement, il doit donc être resté fermé pendant au moins toute une nuit. Afin de récupérer l’ensemble de l’eau du premier jet, il convient d’utiliser un récipient comportant une large ouverture. Ces prélèvements évaluent la présence de légionelles entre la boucle d’ECS et le point d’usage, qui peut lui-même être à l’origine d’une prolifération bactérienne, notamment s’il est entartré. Ils peuvent aussi être effectués après une purge afin d’éliminer l’eau stagnante, et sont alors dits de « deuxième jet » et plus représentatifs d’une contamination éventuelle du réseau bouclé d’ECS. Enfin, ils peuvent être effectués sur des points équipés d’un filtre, afin d’en évaluer l’efficacité.
Le réseau d’ECS est une entité dynamique : l’eau circule dans une partie du réseau tandis qu’elle stagne au niveau des bras morts si les points d’usage ne sont pas utilisés. La prolifération bactérienne varie selon de nombreux paramètres, incluant la température de l’eau, la concentration en chlore, ou encore la présente de tartre favorisant la formation de biofilm. La température de l’eau du réseau d’ECS varie en fonction de plusieurs paramètres : réglage du chauffe-eau en amont du circuit, intensité d’utilisation en aval, qualité du bouclage du réseau et de son calorifugeage (séparation thermique de l’eau chaude et de l’eau froide), etc. Ces conditions influent sur la quantité de légionelles retrouvées dans l’eau qui correspond aux bactéries « libres » circulantes, elles-mêmes en équilibre avec celles présentes à l’intérieur de protozoaires (amibes libres) ou du biofilm, un amas de glucides et de protéines qui immobilise les bactéries et les protège de l’action des désinfectants présents dans l’eau. Ainsi, même si la réalisation du prélèvement est standardisée, le résultat obtenu peut varier d’un jour à l’autre en fonction de cet état dynamique du circuit d’ECS, parfois d’un facteur 1 000, et ce même en l’absence d’intervention significative sur le réseau d’ECS [13].
L’analyse au laboratoire : attention à la quantification
La recherche de légionelles dans un échantillon d’eau est une analyse complexe : elle associe un ensemencement direct de 0,2 mL de l’eau prélevée sur un milieu sélectif à un ensemencement d’un volume plus important (10 et 100 mL) après un traitement sélectif acide et une concentration par filtration. La limite de détection analytique est établie à 10 unités formant colonies (UFC, unité qui correspond à une bactérie vivante) par litre d’eau parce que le volume de filtration ne peut pas dépasser 100 mL d’eau du fait de la taille des filtres disponibles.
Le mode de quantification dépend de la taille de l’inoculum bactérien :
- si la bactérie est présente en grande quantité dans l’eau (au moins 5 000 UFC/L), il suffit de compter le nombre de colonies qui se développent à partir de l’ensemencement direct de 0,2 mL d’eau. Il est à noter que l’utilisation d’un milieu sélectif peut faire varier le nombre de colonies en fonction du fabricant du milieu et de la souche concernée. De plus, chaque colonie sur le milieu de culture correspondant à 5 000 UFC dans le prélèvement, des variations minimes sur le prélèvement initial de 0,2 mL (mauvaise homogénéisation, pipette mal calibrée…) ou des performances médiocres du milieu sélectif de culture peuvent conduire à sous-estimer de façon très significative la numération finale (Figure 2) ;
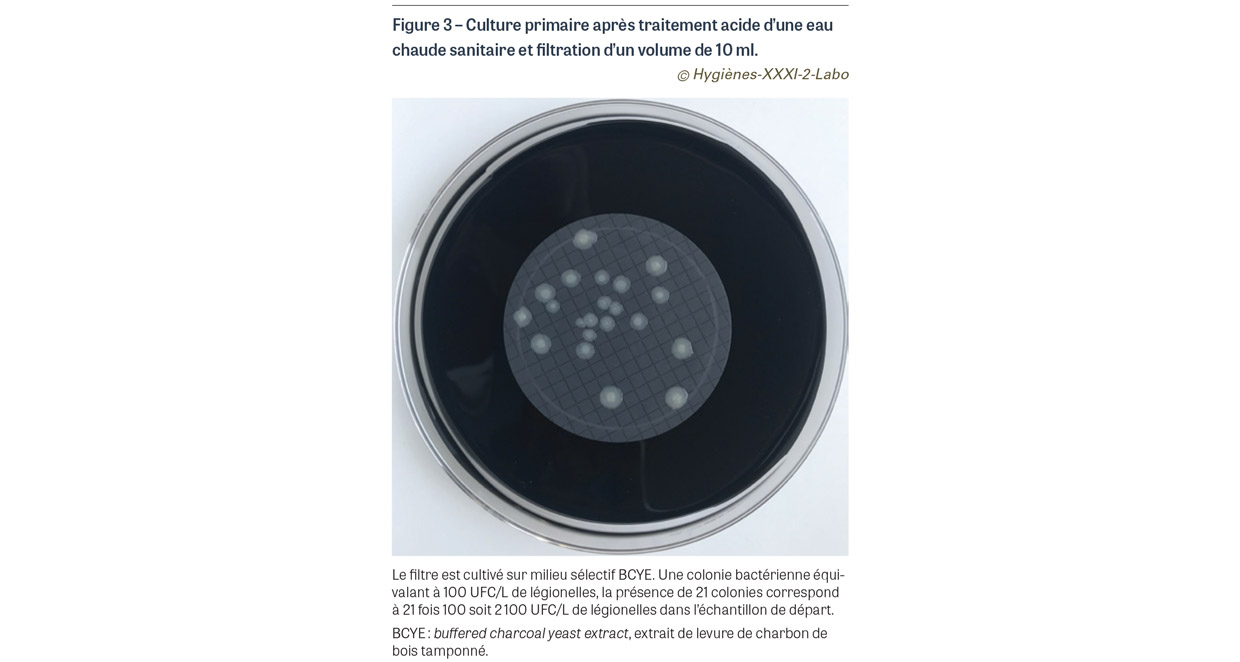
- si la bactérie est en quantité inférieure à 5 000 UFC/L, elle ne sera retrouvée que dans les cultures obtenues à partir du concentrat lui-même obtenu par filtration de 10 mL de 100 mL de l’échantillon initial. Pour éviter les interférences liées à la présence d’autres bactéries, un traitement sélectif par de l’acide est réalisé. Plusieurs paramètres peuvent influer sur le résultat final : la résistance de la souche bactérienne au traitement sélectif à l’acide, les caractéristiques du filtre utilisé et celles du milieu de culture qui varient en fonction du fabricant. Une variation d’une colonie sur l’étape de filtration de 100 mL suivie de la culture du filtre correspond à une variation de 10 UFC/L au niveau du résultat final ; une variation d’une colonie sur l’étape de filtration de 10 mL suivie de la culture du filtre correspond à une variation de 100 UFC/L au niveau du résultat final (Figure 3).
L’impact de l’ensemble de ces paramètres influençant artificiellement la variation du résultat obtenu (type de milieu de culture, type de filtre, résistance à l’acide de la souche bactérienne…) est normalement évalué par le calcul de l’incertitude de mesure, comme pour toutes les analyses biologiques que rendent les laboratoires. La complexité de l’analyse qui associe des cultures en direct (Figure 2) et après une concentration (Figure 3) complique le rendu de la quantification finale ; les abaques officiels permettant de la calculer de façon standardisée ne sont pas encore disponibles. Par ailleurs, le résultat final d’une analyse de recherche de légionelles est obtenu en une dizaine de jours. Son coût n’est pas fixé par une nomenclature comme celle qui régit les actes de biologie médicale ; un coût de 113 euros a été proposé par la Société française d’hygiène hospitalière [14].
En France, les paramètres fixés par les autorités de tutelles pour déclencher les actions correctives sont d’une part la présence de légionelles dans l’eau et d’autre part leur concentration. Le dénombrement de L. pneumophila doit être inférieur à 1 000 UFC/L au niveau de tous les points d’usage mais, dans les services des établissements de santé identifiés comme accueillant des patients vulnérables, ce seuil doit être abaissé au seuil de détection de 10 UFC/L [10]. Si d’un point de vue individuel le risque de légionellose augmente en effet avec la concentration en légionelles dans l’eau, le risque collectif est aussi lié au pourcentage de points d’eau positifs. Aux États-Unis, le risque de légionellose est considéré comme augmenté si le taux de prélèvements positifs dépasse 20% ou 30% des points d’eau [15,16]. Ce critère d’interprétation dépend néanmoins de la stratégie de prélèvement et de la localisation des points d’eau prélevés, qui sont plus ou moins à risque en fonction de leur éloignement de la production d’ECS et du réseau bouclé d’ECS, ou encore de leur fréquence d’utilisation.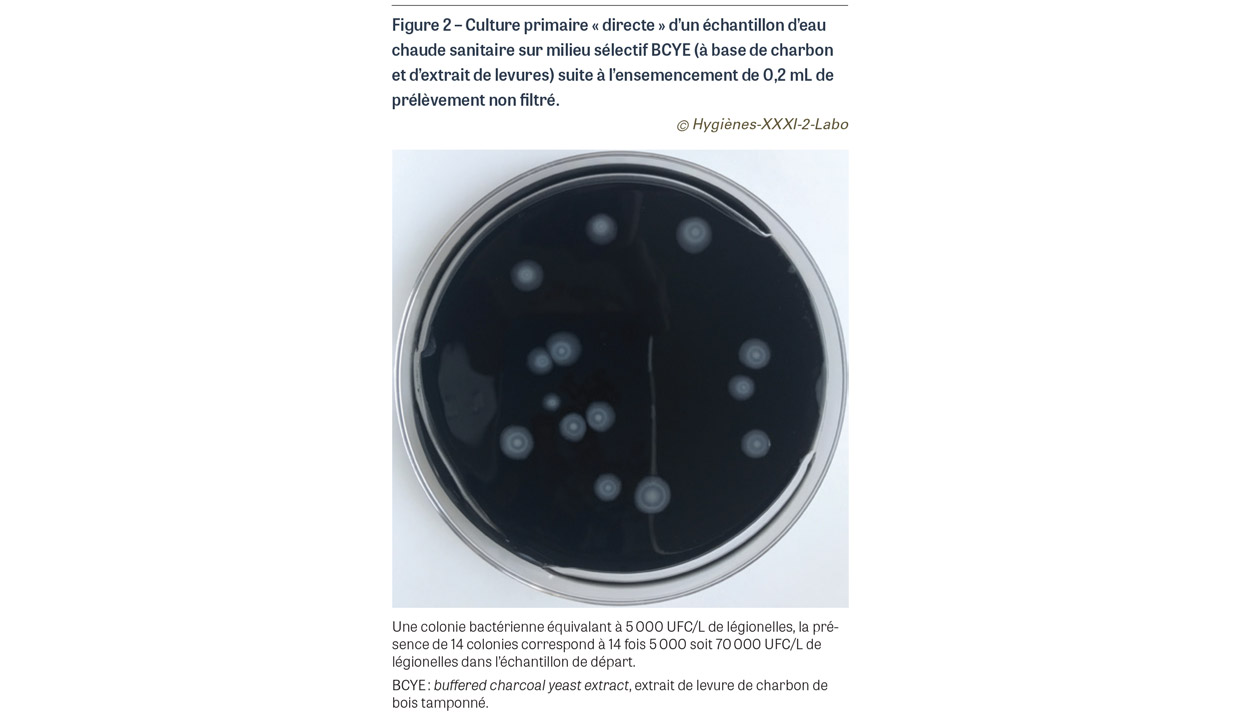
Paramètres non microbiologiques de la surveillance du risque de légionellose
En cas de détection microbiologique de légionelles dans l’eau, les mesures à mettre en place dépendent de l’analyse de différents paramètres qui doivent être mesurés et maîtrisés avant même de réaliser des analyses bactériologiques : recherche et suppression des bras morts dans le réseau, analyse des débits et des températures, suivi des taux de chlore le cas échéant, traçage des purges des points d’usage, prévention de l’entartrage des pommeaux de douche et des robinets, etc. Il est donc indispensable de mettre en place un suivi rigoureux de tous ces paramètres, détaillés dans ce chapitre, dès la mise en place d’un programme de gestion du risque légionelles. La prolifération des légionelles étant optimale lorsque l’eau est stagnante et tiède, la maîtrise du risque de légionellose est basée avant tout sur ces deux paramètres qui doivent être sous contrôle et évalués avant d’effectuer des cultures de légionelles dans l’ECS.
Circulation de l’eau
Le réseau d’ECS (Figure 1) doit être connu et sa taille doit être adaptée aux besoins du bâtiment. Les débits d’eau doivent être connus afin de s’assurer que l’eau circule suffisamment. Les plans du réseau doivent être mis à jour régulièrement tant les changements sont fréquents et modifient la circulation de l’eau : transformation d’une chambre en bureau, ajout ou retrait d’un point d’eau… Cette étape cruciale est indispensable, notamment pour activer la suppression des bras morts, source de prolifération des légionelles. En pratique, les plans des bâtiments anciens sont généralement obsolètes et leur mise à jour, coûteuse, est souvent reportée. Des plans actualisés sont pourtant indispensables à une gestion raisonnée des prélèvements. Les purges des points d’usage peu utilisés doivent être effectuées et tracées plusieurs fois par semaine. Cette exigence est particulièrement difficile à remplir quand tout ou partie d’un service est fermé, en période de vacances ou dans un contexte de travaux ou de manque de personnel.
Température de l’eau chaude sanitaire
La température est un paramètre essentiel de la maîtrise de la prolifération des légionelles, qu’elle favorise quand elle est inférieure à 50°C. Elle doit être élevée à la sortie de production de l’ECS, en retour de boucle et à chaque point d’usage. Pour cette dernière localisation, la température de l’ECS est difficile à mesurer puisque l’eau chaude est volontairement mélangée avec de l’eau froide pour éviter les brûlures des utilisateurs : il faut donc la mesurer avant qu’elle ne soit mitigée [17]. Ce suivi des températures à la production, en retour de boucle et aux points d’usage les plus défavorisés doit être régulière, idéalement en continu à l’aide de sondes thermiques reliées à un logiciel centralisant les données sous la forme de courbes de suivi (Figure 4). C’est un prérequis indispensable avant toute recherche de légionelles dans l’eau. Des valeurs trop basses sont associées à un risque accru de prolifération de légionelles quel que soit le résultat des recherches microbiologiques dans les prélèvements.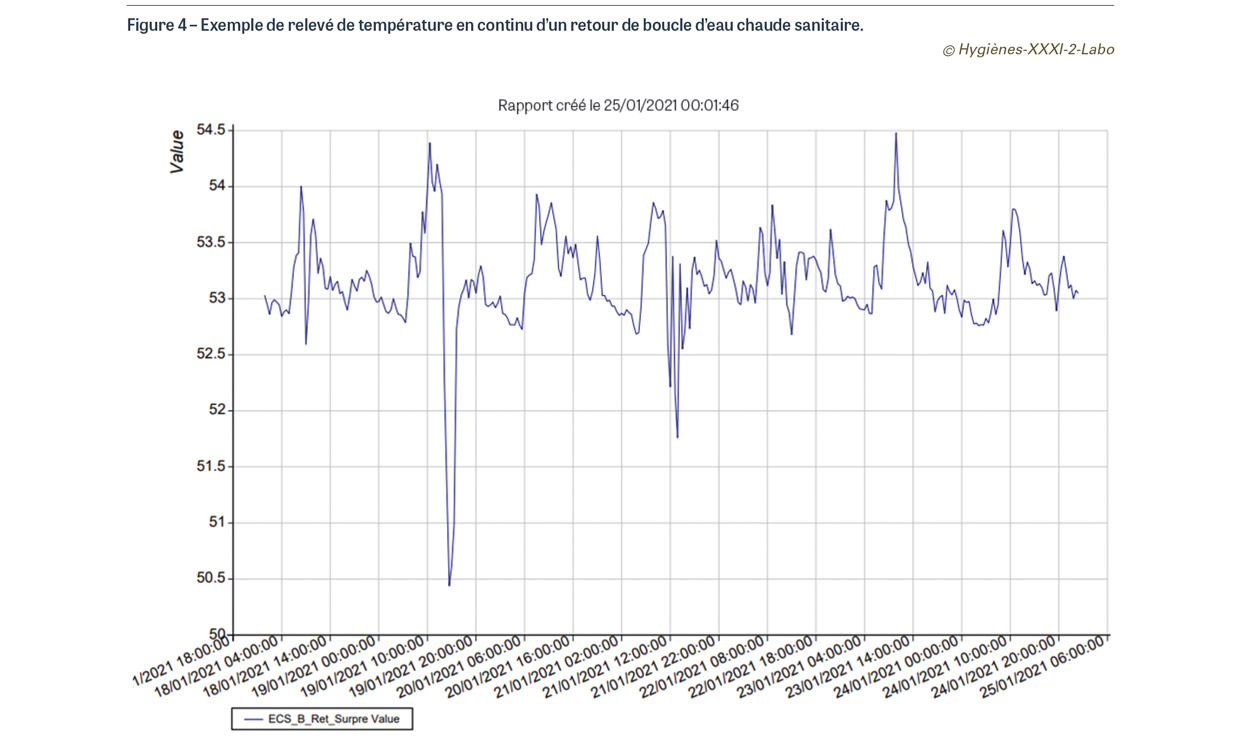
Autres paramètres
D’autres paramètres peuvent être également suivis. En cas de chloration en continu, le suivi du taux de chlore permet de s’assurer de l’efficacité de la pompe à chlore et de la circulation du chlore à des taux suffisants pour neutraliser les bactéries présentes. Les valeurs cibles varient entre 0,5 et 1 mg/L. Seul le chlore libre est efficace et a une activité antibactérienne, il peut être lié donc neutralisé par du matériel organique. Il ne peut agir que s’il diffuse et est renouvelé régulièrement : son efficacité est donc aussi liée à la circulation de l’eau et aux purges. Comme la température, l’obtention des valeurs du taux de chlore est rapide et beaucoup moins coûteuse que la recherche de légionelles par le laboratoire. En cas de filtration, la mise en place d’une traçabilité et d’audits réguliers du changement des filtres est un préalable important aux prélèvements. Enfin, l’état des points d’usage est également un élément critique à surveiller, notamment pour prévenir et traiter l’entartrage des pommeaux de douche et des brise-jets. Ce suivi est indispensable et doit faire l’objet d’actions préventives à périodicité définie (démontage, détartrage, désinfection, remontage ou changement systématique).
Conclusion
La recherche microbiologique de légionelles dans l’ECS est indissociable d’un ensemble de mesures institutionnelles visant à gérer le risque légionelles dans sa globalité ; cette stratégie de surveillance est sous la responsabilité du chef de l’établissement de santé. Les volontés actuelles, partagées par les hygiénistes, de réduire la consommation d’eau et d’énergie sont louables mais ne doivent pas interférer avec la prévention du risque de légionellose [18]. Soucieuses de ces nouvelles tendances mais aussi du respect d’une réglementation pointilleuse, les personnes chargées du risque légionelles dans un établissement de santé (services techniques, direction…) sont très demandeuses de recherches microbiologiques de légionelles dans l’ECS pour s’assurer de sa conformité à la norme, en négligeant parfois la mise en place de mesures environnementales préventives ou leur suivi régulier. Les travaux et mesures nécessaires (rédaction des plans du réseau, adaptation de la production et du circuit d’ECS à la consommation, purge hebdomadaire des points d’eau inutilisés, suivi des températures et, le cas échéant, des taux de chlore, calorifugeage des réseaux d’eau froide et d’eau chaude…) étant beaucoup plus coûteux que les analyses, la tentation est grande de multiplier les prélèvements. Non seulement cette approche n’a pas de sens, mais elle ne permet en rien de s’assurer de la maîtrise du risque légionelles même si les prélèvements restent conformes, tant les concentrations en légionnelles peuvent varier dans le réseau d’eau. En effet, bien que particulièrement encadrée par des normes régulièrement mises à jour, cette variabilité des résultats des recherches de légionelles dans l’ECS hypothèque sérieusement l’interprétation de résultats obtenus en dehors d’une stratégie générale réfléchie, maîtrisée et suivie, et cela tant d’un point de vue qualitatif (détection ou non de légionelles) que quantitatif (concentration de légionelles).
Les légionelles et les amibes étaient dans l’eau avant que l’être humain ne soit sur terre, et la culture de prélèvements d’eau itératifs difficiles à standardiser ne le mettra pas à l’abri d’une possible infection par ces bactéries. La détection de légionelles au laboratoire n’est que la cerise sur le gâteau d’un plan global de maîtrise du risque environnemental, même si cette cerise a ses propres exigences techniques et réglementaires qu’il convient de bien appréhender.
Notes :
1- Coronavirus disease 2019, maladie à coronavirus 2019.
2- Cofrac : https://www.cofrac.fr/ (Consulté le 22-3-2023).