Après différents chapitres consacrés aux antibiotiques et à l’exploration in vitro des résistances des bactéries à ces médicaments, ce nouvel épisode propose une incursion dans le monde très particulier des antiviraux destinés à combattre certaines maladies causées par des virus. À la différence des bactéries qui sont toutes, peu ou prou, sensibles à des antibiotiques, seulement quelques pathologies virales humaines sont accessibles à des traitements par des antiviraux.
Au sens large, les antiviraux sont des composés capables de bloquer spécifiquement, de façon directe ou indirecte, la multiplication des virus à l’intérieur des cellules. Comme les antibiotiques vis-à-vis des bactéries, les antiviraux ne sont actifs que sur des virus en phase de multiplication active, ce qui exclut par exemple une efficacité sur les virus latents ou sur ceux dont le génome est intégré à celui de la cellule. Comme les bactéries vis-à-vis des antibiotiques, les virus sont capables de développer, parfois très rapidement, des résistances aux antiviraux ; mais la comparaison s’arrête là car ces résistances, toujours préoccupantes à l’échelon individuel, ne revêtent pas la gravité des résistances bactériennes aux antibiotiques sous l’angle collectif de l’écologie virale. L’absence d’utilisation d’antiviraux pour traiter des pathologies vétérinaires contribue aussi à limiter la dissémination des résistances. Par ailleurs, à l’inverse des pathologies bactériennes où l’utilisation prophylactique des antibiotiques reste limitée à des indications très restrictives, nous verrons que l‘utilisation prophylactique de certains antiviraux constitue une stratégie très efficace à côté de leur utilisation à titre curatif et que la précocité des traitements est souvent le meilleur gage de succès. Après quelques rappels sur les différents modes d’action des antiviraux, ce qui nécessite de comprendre a minima le cycle des virus au niveau de la cellule, nous envisagerons les principales pathologies virales qui peuvent bénéficier d’un traitement antiviral en 2025, ainsi que les phénomènes de résistance susceptibles d’entraver leur efficacité. Nous présenterons ensuite de façon succincte les méthodes d’étude au laboratoire de microbiologie de la résistance des virus aux antiviraux, dont les indications sont beaucoup plus limitées que celles, quasi systématiques, des tests de résistance des bactéries aux antibiotiques.
Introduction
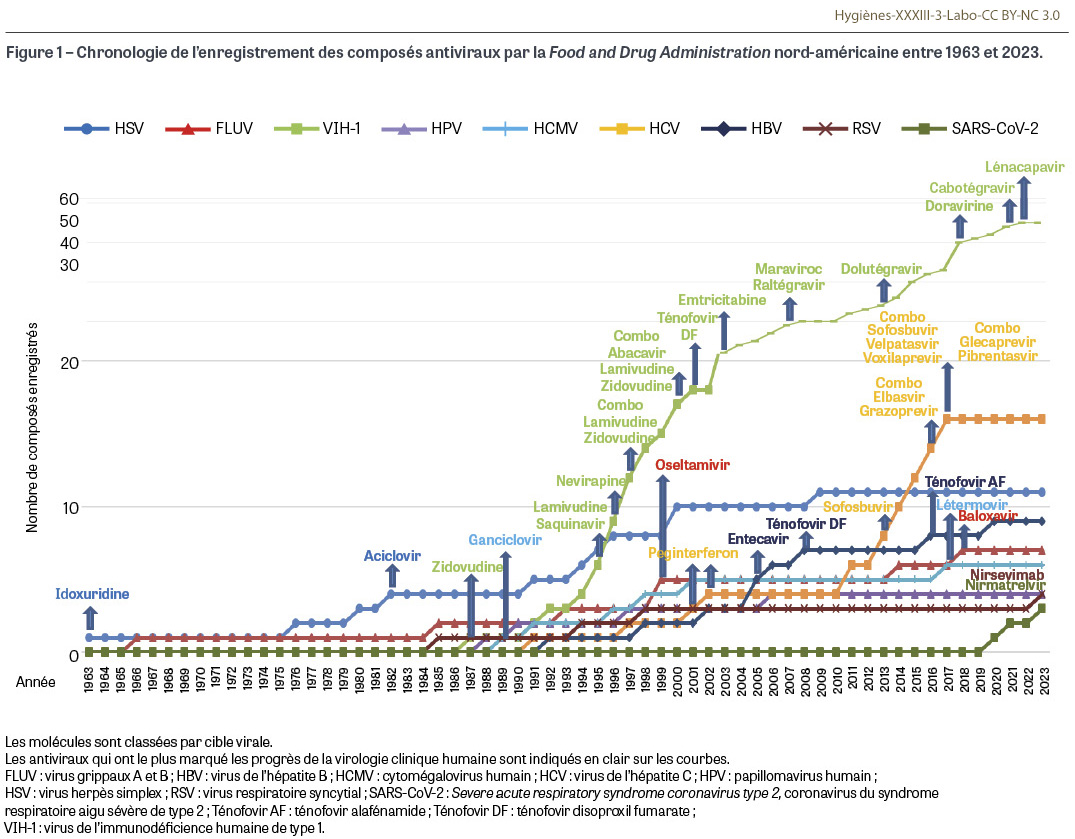
Il a fallu attendre près de quinze ans après la mise en place de l’antibiothérapie pour voir en 1963 l’enregistrement aux États-Unis du premier antiviral à usage thérapeutique, l’idoxuridine, actif sur le virus herpès simplex (HSV), sous forme de collyre destiné à combattre les pathologies oculaires associées à cet agent. Les traitements antiviraux se sont développés très lentement au rythme de la découverte des nouvelles molécules, d’abord de façon isolée puis en combinaison, avec un nombre de composés très variable d’une pathologie à l’autre. À ce jour, près de 115 molécules ou combinaisons de molécules ont été enregistrées par la Food and Drug Administration1 nord-américaine (US-FDA), et une centaine d’entre elles est encore utilisée à ce jour2 (Figure 1, annexe I). Les antiviraux ont révolutionné la prise en charge de plusieurs pathologies virales : ils ont permis le contrôle de certaines infections graves à Herpesviridae ; ils ont transformé le pronostic de l’infection à VIH-13 qui est passé d’une maladie presque toujours mortelle dans les années 1980 à une infection chronique parfaitement maîtrisée dont l’éradication est entrevue à l’horizon des cinq à dix prochaines années ; ils permettent la guérison définitive en un à deux mois de la quasi-totalité des hépatites C chroniques, pour ne citer que les succès les plus éclatants des thérapies antivirales. La découverte de nouveaux antiviraux se poursuit à un rythme soutenu, notamment dans le cadre des pathologies respiratoires (grippe, infections à virus respiratoire syncytial, infections à coronavirus…). Les lecteurs intéressés par la saga des antiviraux peuvent consulter la remarquable revue publiée par Erik de Clercq, un des pionniers francophones dans ce domaine, qui brosse un tableau très exhaustif des connaissances sur le sujet en 2017 [1], et d’autres synthèses plus récentes [2,3,4].
Rappels succincts sur le mode d’action des antiviraux au cours du cycle de réplication virale
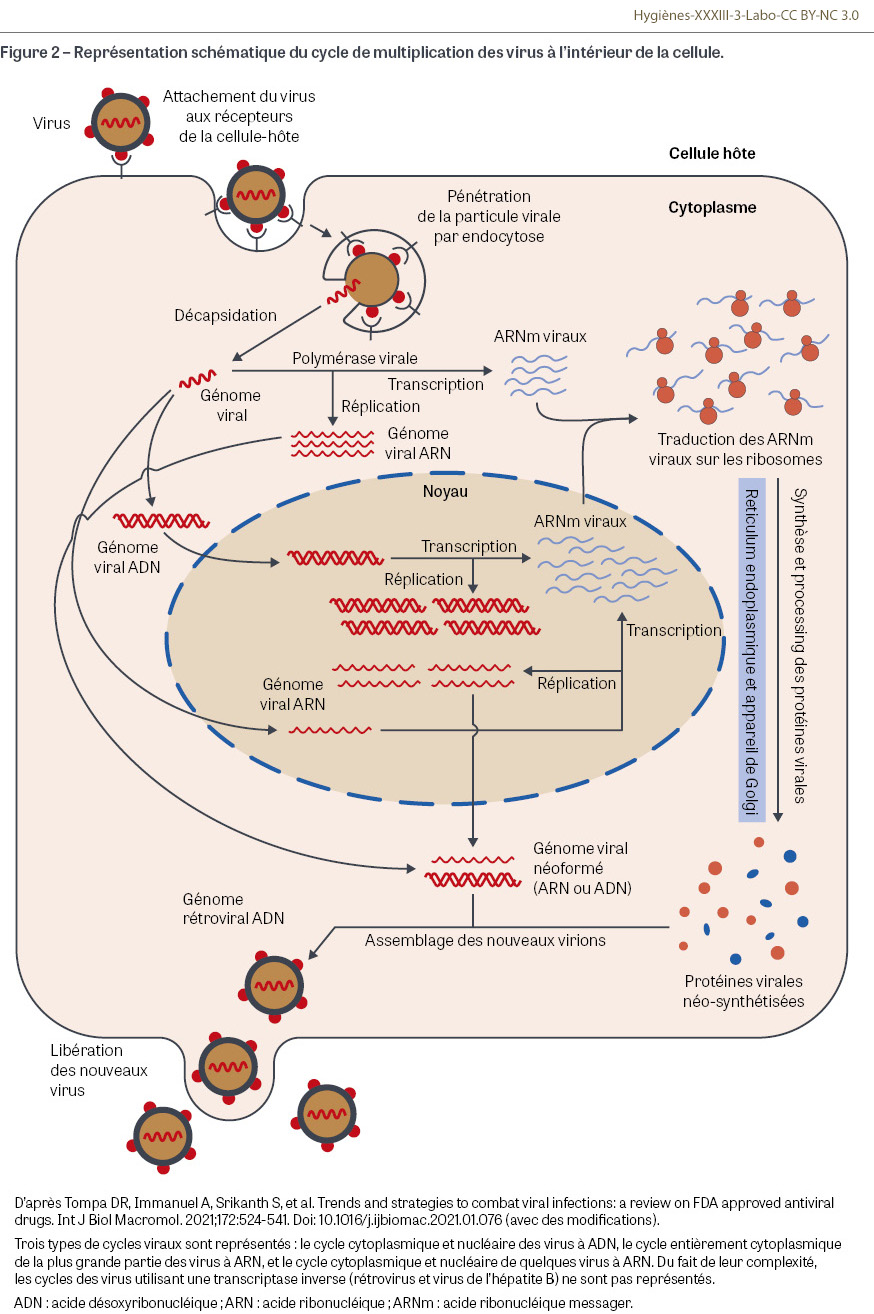
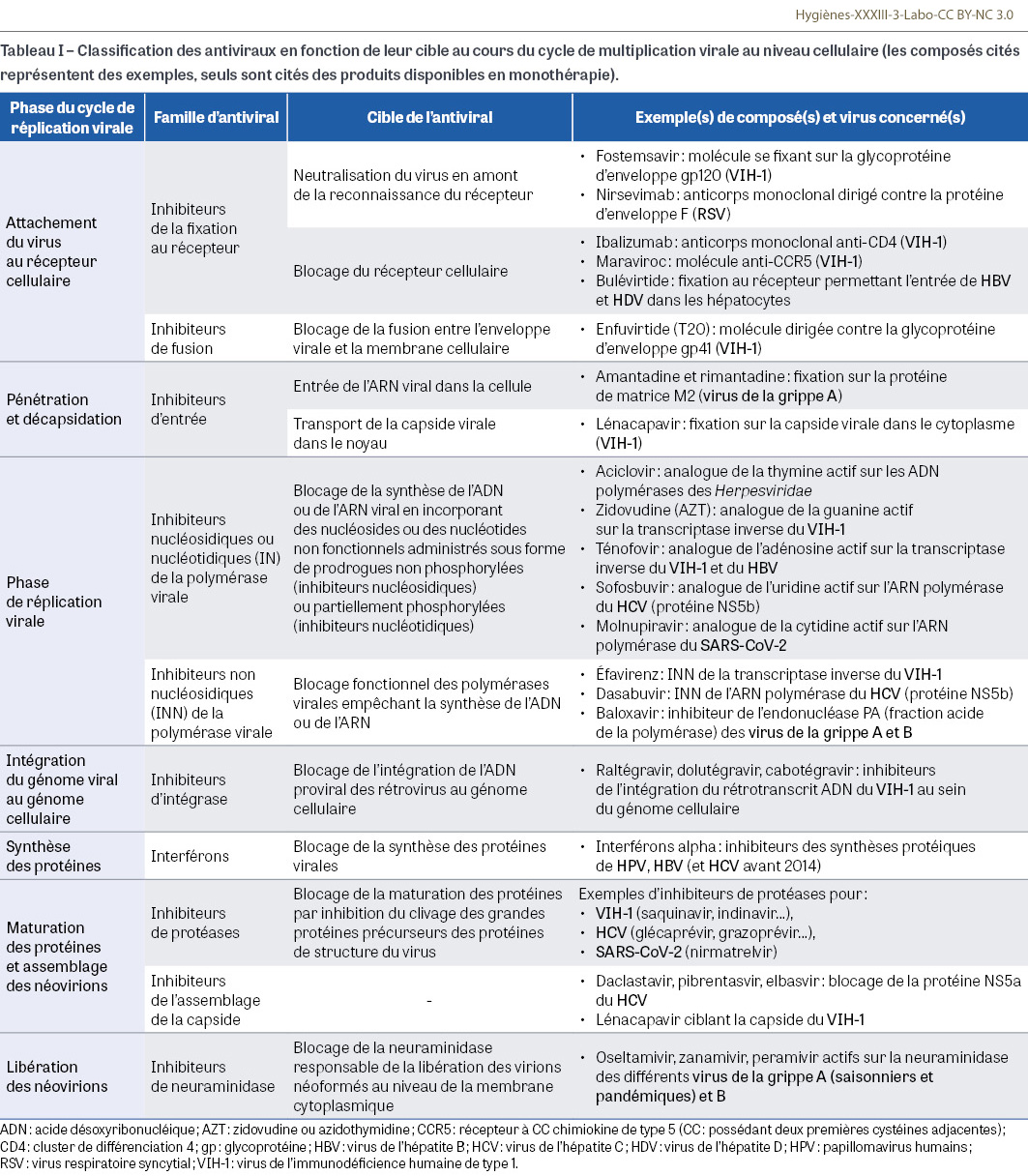
Les virus sont des parasites intracellulaires obligatoires et leur réplication est entièrement dépendante des machineries cellulaires qu’ils détournent à leur bénéfice pour reconstituer tout leur matériel, principalement composé d’acides nucléiques (ADN ou ARN4) et de protéines. L’action des antiviraux est strictement virostatique, ce qui nécessite le relais de l’immunité pour contrôler complètement les infections. Les étapes de la réplication du virus dans la cellule sont importantes à connaître pour comprendre la cible des antiviraux au cours du cycle cellulaire (Figure 2). En effet, contrairement aux antiseptiques et désinfectants qui agissent de façon beaucoup moins ciblée [5], les composés antiviraux présentent, comme les antibiotiques, une très grande spécificité d’action avec parfois plusieurs cibles (Tableau I). La phase de réplication virale est particulièrement concernée par l’action des antiviraux. L’enzyme clé est la polymérase synthétisée par le virus. On en distingue trois grands types :
- les ARN polymérases ARN-dépendantes qui synthétisent l’ARN viral soit en restant au niveau cytoplasmique (cas de la majorité des virus à ARN), soit en nécessitant un passage du génome au niveau du noyau (cas des virus grippaux A et B) (Figure 2) ; si le génome ARN du virus est orienté dans le sens « messager » 5’-3’ (entérovirus, coronavirus, flavivirus…), le génome peut directement être traduit au niveau ribosomal ; en revanche, en cas de génome orienté dans le sens 3’-5’ (virus grippaux, virus respiratoire syncytial [RSV], virus parainfluenza, virus de la rougeole ou des oreillons…), le virus doit amener sa propre polymérase afin de produire une copie 5’-3’ capable de servir de messager ;
- les ADN polymérases ADN-dépendantes qui synthétisent l’ADN viral au niveau du noyau cellulaire ; c’est la situation de la majorité des virus à ADN (Figure 2) ;
- les ADN polymérases ARN-dépendantes ou transcriptases inverses qui synthétisent une copie ADN à partir de l’ARN génomique ; c’est le cas des rétrovirus (VIH notamment) et du virus de l’hépatite B (HBV). Pour les rétrovirus (virus à ARN), il existe une phase obligatoire d’intégration de la totalité du génome proviral au niveau de l’ADN cellulaire après la phase de transcription inverse ; les inhibiteurs d’intégrase (Tableau I) sont de puissants inhibiteurs de la réplication virale ; pour le virus de l’hépatite B (virus à ADN), l’intégration est facultative et peut ne concerner qu’une partie du génome.
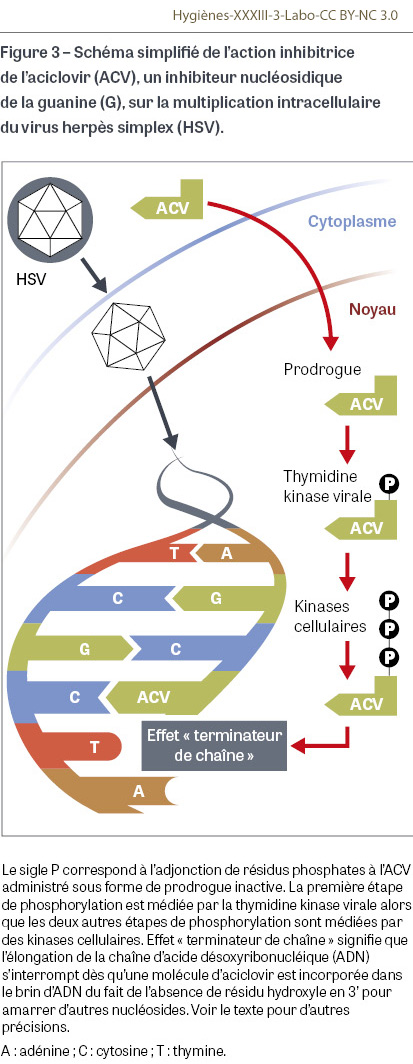
L’aciclovir, un inhibiteur nucléosidique de la polymérase de certains Herpesviridae, représente l’archétype des antiviraux dans la mesure où il cumule un grand nombre de qualités : faible toxicité hors insuffisance rénale, très grande affinité pour les polymérases de certains Herpesviridae alors qu’il est très peu utilisé par les polymérases cellulaires, administration sous forme de prodrogue inactive qui nécessite une triple phosphorylation pour devenir un analogue de la guanidine capable d’entrer en compétition avec les nucléosides naturels, rôle central de la thymidine kinase virale pour initier la première phosphorylation alors que les thymidines kinases des cellules non infectées par un Herpesviridae sont très peu affines de la prodrogue, enfin effet « terminateur de chaîne » qui, lorsqu’une molécule d’aciclovir triphosphate s’incorpore dans la chaîne naissante d’ADN viral, provoque un arrêt de l’élongation du fait de l’absence de radical hydroxyle (OH) en 3’ qui empêche les autres nucléosides de se fixer (Figure 3). L’aciclovir, qui a valu le prix Nobel de médecine à Gertrude B. Elion et John Hitchings en 1988, conserve plus de quarante ans après son entrée (1982) dans l’arsenal de l’US-FDA une remarquable activité antivirale sous différentes formes (topiques cutanés, gynécologiques ou ophtalmiques, formes orales améliorant son absorption digestive, poudre utilisée par voie intraveineuse pour les infections neurologiques ou néonatales graves…), et ce malgré sa disponibilité en vente libre sur le marché international, avec un taux de résistance minime (de quoi rendre jalouse sa « sœur aînée » la pénicilline !).
Principales pathologies virales pouvant bénéficier d’un traitement antiviral en 2025
Infections à Herpesviridae
Comme évoqué supra, les composés actifs sur les virus herpès simplex (HSV) et varicelle-zona (VZV) ont été les premiers à inaugurer la saga des antiviraux. À côté de pathologies cutanéomuqueuses parfois très invalidantes du fait de leurs récurrences, comme l’herpès génital, ces virus sont responsables d’infections neurologiques graves potentiellement mortelles à tous les âges de la vie ainsi que d’infections chroniques très rebelles chez les immunodéprimés. L’aciclovir et ses dérivés ont transformé le pronostic de ces pathologies à condition de les prescrire très précocement. La seule évocation du diagnostic d’encéphalite herpétique ou varicelleuse doit conduire à un traitement curatif par aciclovir par voie intraveineuse jusqu’à la démonstration de l’absence de confirmation d’infection par ces agents à l’aide de tests d’amplification génique dans le liquide cérébrospinal. Les résistances du HSV à l’aciclovir sont observées essentiellement chez les immunodéprimés et justifient d’utiliser d’autres composés comme le foscarnet, un autre inhibiteur de l’ADN polymérase virale, plus toxique mais avec un faible risque de résistance croisée [6,7,8] ; l’arrêt de l’aciclovir s’accompagne en général d’un retour à la sensibilité des virus résistants en raison du « prix à payer » pour le virus en termes de baisse de la capacité réplicative (on parle de baisse de fitness viral). Des inhibiteurs nucléosidiques proches de l’aciclovir sont également disponibles pour le cytomégalovirus humain (HCMV), un autre herpèsvirus responsable d’infections potentiellement graves lorsqu’elles surviennent au cours du premier trimestre de grossesse, avec des risques de mort fœtale, de syndromes polymalformatifs et de surdités ; HCMV est également responsable d’infections pulmonaires ou neurologiques sévères chez les immunodéprimés (transplantés d’organe et de moelle osseuse, ou malades atteints de sida notamment). Le ganciclovir administré précocement peut permettre de prévenir ou de contrôler ces infections. En cas d’échec du ganciclovir chez l‘immunodéprimé, il faut rechercher une résistance avec possibilité de changer pour d’autres antiviraux (foscarnet, cidofovir, létermovir, maribavir) encore efficaces [9,10]. Un essai récent de valaciclovir (une forme orale d’aciclovir) à haute dose a montré l’efficacité de cette molécule pour réduire la transmission virale au cours de la primo-infection à HCMV quand elle survient au premier trimestre de grossesse [11].
Infections par le virus de l’immunodéficience humaine de type 1
La pandémie à virus VIH-1 qui a déferlé sur le monde à partir des années 1980 est créditée à ce jour de plus de 40 millions de décès. Un nombre à peu près équivalent (37 millions) de personnes vivent avec ce virus à travers le monde. Il a fallu attendre 1987 pour que la zidovudine ou azidothymidine (AZT), un inhibiteur nucléosidique de la transcriptase inverse du VIH, démontre sa capacité à ralentir la mortalité de la maladie. Dix années supplémentaires ont été nécessaires pour aboutir au concept de trithérapie avec le développement d’une gamme impressionnante d’antiviraux (Figure 1) actifs à toutes les étapes du cycle viral : analogues nucléosidiques (et nucléotidiques) et non nucléosidiques de la transcriptase inverse, inhibiteurs de protéases, inhibiteurs d’intégrase, inhibiteurs d’entrée et, plus récemment (2022), inhibiteur de la fonctionnalité de la capside virale (Tableau I). Le taux très élevé de mutations du génome du VIH-1, y compris chez les sujets asymptomatiques (de l’ordre de 0,1 à 1 mutation par génome synthétisé pour 109 à 1010 virions produits par jour), explique les échecs initiaux des monothérapies et la transmission très efficace de l’infection. Après des années d’errances physiopathologiques, la possibilité de contrôler la « charge virale » sanguine (tests d’amplification géniques disponibles à partir des années 1995) à l’aide de multithérapies (trois à cinq molécules) a permis de sauver la vie de patients au stade sida, de généraliser les traitements combinés dès la découverte de la séropositivité VIH et d’aboutir au concept « I=I », c’est-à-dire en franglais « indétectable = intransmissible ». À l’orée du XXIe siècle (2016), cette affirmation a permis de laisser espérer qu’à condition de dépister 95% des porteurs de virus, de traiter 95% d’entre eux et d’obtenir une annulation de la charge virale circulante chez 95% des sujets traités à l’échelle mondiale, il devenait possible d’espérer une disparition des porteurs de virus, donc un arrêt de l’épidémie à l’horizon des années 2030. C’est l’origine du programme ambitieux porté par l’Organisation mondiale de la santé depuis 2020 à l’échelle internationale [12]. Dans les pays « pauvres », l’intensification du dépistage, la course aux génériques bon marché et la lutte contre les discriminations laissent espérer un ralentissement de l’épidémie, avec ces objectifs 95-95-95 déjà atteints dans plusieurs pays d’Afrique sub-saharienne (Botswana, Eswatini, Rwanda, Tanzanie et Zimbabwe), région du monde qui cumule pourtant le plus grand nombre de cas. Dans les pays « riches », la simplification des traitements (traitements combinés5, espacement des prises, allègement du nombre de molécules et réduction des posologies, donc des effets indésirables…) a fait de l’infection VIH-1 une pathologie chronique dotée d’une espérance de vie proche de celle des sujets non infectés. Un nouveau concept a vu le jour avec l’avènement des prophylaxies pré-exposition, dites PrEP6, qui consistent à administrer des quantités faibles d’antirétroviraux, par voie orale ou injectable, à des sujets non infectés mais fortement exposés afin de prévenir les contaminations. Ces approches thérapeutiques prophylactiques à base d’antiviraux traditionnels ou d’anticorps monoclonaux à large spectre font l’objet de recherches épidémiologiques afin de faire baisser le nombre des nouvelles infections dans les zones de forte endémie [13,14,15]. Grâce à la multiplication des cibles thérapeutiques, à la puissance antirétrovirale des nouvelles molécules (anti-intégrases notamment), à la facilitation de l’observance et à la surveillance rapprochée de la charge virale, les échappements thérapeutiques sont de plus en plus rares ; en cas de détection de résistances, la variété des molécules disponibles permet de proposer des alternatives thérapeutiques dans la majorité des situations [16,17,18]. Au total, malgré l’échec des stratégies vaccinales, les succès de la chimiothérapie antivirale sont en train de laisser entrevoir la fin de l’épidémie à VIH-1. Le VIH-2, dont l’importance épidémiologique est beaucoup plus limitée, est globalement sensible aux mêmes molécules que le VIH-1, avec des exceptions notables puisqu’il est intrinsèquement résistant aux inhibiteurs non-nucléosidiques de la transcriptase inverse, à l’enfuvirtide (T-20), à certains inhibiteurs de protéases et à un inhibiteur d’entrée, le fostemsavir [19].
Hépatite B
Bien que disposant d’un excellent vaccin pour sa prévention, l’infection à HBV reste un important fardeau de santé publique en raison du nombre très élevé de sujets infectés au niveau mondial (de l’ordre de deux milliards) ; 250 000 d’entre eux sont porteurs chroniques de l’antigène HBs avec un risque d’évolution vers le cancer primitif du foie et la cirrhose. Comme pour VIH, les sujets infectés naturellement par HBV deviennent porteurs à vie du génome viral au niveau hépatocytaire. Bien qu’HBV soit un virus à ADN, son génome doit passer par un stade génomique ARN avant de redonner une molécule d’ADN grâce à une transcriptase inverse codée par le virus. Cette particularité explique pourquoi les traitements viraux anti-HBV reposent principalement, comme pour VIH, sur des inhibiteurs de la transcriptase inverse. Certains comme le ténofovir ou l’emtricitabine sont actifs sur les deux virus tandis que d’autres (entécavir) sont réservés au HBV. Bien que ces produits soient utilisés en monothérapie et à vie depuis plus de quinze ans dans le traitement des hépatites B chroniques, les résistances sont exceptionnelles [20]. Les indications des chimiothérapies antivirales au cours de l’hépatite B chronique concernent principalement les sujets porteurs, au-delà de la phase dite d’immunotolérance, d’une charge virale spontanément élevée afin de réduire les risques de complications hépatiques mentionnées plus haut et d’interrompre les risques de transmission. Contrairement à ces traitements qui sont définitifs une fois qu’ils ont été commencés, il est possible chez certains profils de patients d’envisager des cures transitoires à base d’interféron alpha retard qui peuvent permettre de contrôler durablement la charge virale. Il convient enfin de signaler la disponibilité récente (2020) d’un nouvel inhibiteur d’entrée, le bulévirtide, qui bloque les récepteurs utilisés par HBV pour entrer dans les hépatocytes (Tableau I) ; ce traitement est notamment utilisé au cours des co-infections par les virus des hépatites B et D car ce second virus, encore nommé virus de l’hépatite delta et qui est considéré comme un facteur aggravant du pronostic des hépatites B chroniques, emprunte au HBV son enveloppe pour entrer dans les hépatocytes [21].
Hépatite C
Avec l’infection à VIH, l’hépatite C représente sans doute le plus grand succès de la chimiothérapie antivirale. Le virus de l’hépatite C (HCV) est un flavivirus à ARN qui présente la particularité d’induire une infection chronique chez 70% à 80% des personnes infectées. Dans une proportion de cas évaluée à environ 10% par an, cette infection peut se compliquer, comme pour l’hépatite B, par une cirrhose du foie et un cancer hépatique (en général à partir de nodules de cirrhose). Longtemps suspecté et nommé agent non-A non-B, le HCV n’a été formellement identifié qu’en 1989. Grâce à la mise en place de tests diagnostiques fiables, il a été possible d’identifier les très nombreux porteurs chroniques du virus actuellement évalués à 50 millions à l’échelle de la planète. Très rapidement après la découverte du virus, des traitements prolongés (de six à douze mois) à base d’interféron alpha recombinant ont été proposés pour traiter l’hépatite chronique C avec des résultats très partiels au prix d’effets indésirables importants sous l’angle neuropsychiatrique. En 1998, l’adjonction de la ribavirine à l’interféron retard a sensiblement amélioré les taux de réponse mais au prix de complications hématologiques supplémentaires. L’arrivée sur le marché d’antiviraux directs en 2011 a bouleversé le pronostic de la maladie ; en dix ans est apparue sur le marché une douzaine de spécialités, en monothérapie ou sous forme combinée, appartenant à trois grandes catégories d’antiviraux : inhibiteurs nucléosidiques ou non nucléosidiques de l’ARN polymérase (NS5b7), inhibiteurs de protéase (NS3) et inhibiteurs de la protéine NS5a impliquée dans l’assemblage de la capside (Tableau I). Des recommandations thérapeutiques européennes ont été publiées en 2020 [22]. Six spécialités couvrent l’ensemble des besoins (une association de deux composés, trois bithérapies combinées et une trithérapie combinée). L’intérêt de ces traitements est d’entraîner une guérison définitive de l’hépatite C en un à deux mois, avec une très bonne tolérance et une efficacité virologique à douze mois de 91% à 100% selon les génotypes et les produits [23]. Le principal obstacle à l’éradication rapide de l’infection à HCV au niveau mondial reste le coût élevé des traitements pour les pays à faibles revenus.
Infections respiratoires
- La grippe est une pathologie ubiquitaire très répandue due à des virus à ARN à génome segmenté induisant une très grande variabilité. Tandis que le virus de la grippe B circule essentiellement dans l’espèce humaine, le virus de la grippe A présente un réservoir zoonotique très vaste avec la possibilité de réassortiments entre segments d’ARN de différents virus à l’origine de l’émergence de nouvelles souches susceptibles de générer des pandémies. Ainsi l’épidémiologie humaine de la grippe est marquée par des épidémies saisonnières annuelles de virus grippaux A et B et des épisodes pandémiques à virus A beaucoup plus rares (quatre entre 1900 et 2025) mais très meurtriers. En plus de la vaccination qui demeure l’arme prophylactique essentielle, les chimiothérapies antivirales constituent un appoint à la fois sur les plans préventif et curatif. Après l’arrêt de la commercialisation des composés actifs sur la protéine M2 du fait de leur activité exclusive sur les virus de la grippe A et surtout de l’émergence très rapide de virus résistants, les composés les plus utilisés sont les inhibiteurs de neuraminidase (INA) (oséltamivir, zanamivir, peramivir…) qui bloquent la libération des virions néoformés à l’intérieur de la cellule (Tableau I). L’efficacité de ces composés sur l’ensemble des virus grippaux A (saisonniers et pandémiques) et B est directement proportionnelle à la rapidité de leur administration avec un raccourcissement de la durée de la maladie et de la phase de contagion s’ils sont administrés précocement ; administrés à titre préventif, ils protègent très efficacement les individus exposés ; en revanche, au-delà du troisième jour post-infection, le bénéfice clinique devient très modeste, ce qui limite leur utilisation en l’absence de diagnostic virologique rapide. Leur intérêt dans les formes graves reste limité [24]. De nombreux composés actifs sur d’autres cibles virales sont en développement [25,26]. Parmi les composés bénéficiant d’une autorisation de mise sur le marché, on peut citer le baloxavir marboxil actif sur la fraction PA8 du complexe polymérasique (Tableau I) et qui présente l’intérêt de comporter une dose orale unique ; l’efficacité clinique est proche de celle des INA. Les composés antigrippaux font l’objet de stocks d’État en vue de la préparation d’un épisode pandémique [27].
- L’infection à virus respiratoire syncytial (RSV) représente un défi annuel pour les tranches d’âge situées aux deux extrêmes de la vie (nourrissons de moins de deux ans et personnes âgées) avec des pathologies respiratoires sévères (bronchiolites, bronchites asthmatiformes, pneumonies…) à l’origine de nombreuses hospitalisations chez les jeunes enfants et de défaillances cardio-respiratoires responsables de décès chez les sujets âgés présentant des comorbidités. Les premiers essais vaccinaux chez les enfants remontant à plusieurs dizaines d’années ont été des échecs ; de nouveaux vaccins sont en cours de déploiement, notamment chez les femmes enceintes pour renforcer l’immunité passive transmise au nouveau-né. En parallèle de cette approche, des anticorps monoclonaux peuvent être proposés à titre préventif au cours de la première année de vie sous forme d’une injection unique en début de saison hivernale afin de retarder la survenue de la primo-infection et de minimiser les formes graves. Cette stratégie, réservée dans les années 2000 aux enfants prématurés ou fragiles en raison de son coût (palivizumab), a été étendue en 2023 à l’ensemble des enfants en dessous d’un an (nirsevimab) avec des résultats très intéressants dès la première saison en termes de réduction des hospitalisations de formes graves de bronchiolite à RSV en dessous de l’âge d’un an [28,29].
- La récente pandémie de Covid-199 a été l’occasion de polémiques interminables autour du repositionnement d’anciennes molécules prétendument actives sur le SARS-CoV-210, comme si ce type de stratégie était habituel en thérapie antivirale, ce que dément toute la saga des antiviraux résumée dans cet article. Si les corticoïdes, les thérapies à visée vasculaire et l’assistance respiratoire ont joué un rôle décisif dans la prise en charge des patients atteints de Covid-19 sévère, le bilan des recherches en matière d’antiviraux est assez maigre avec l’enregistrement de trois composés aux performances assez modestes. Le remdesivir et le molnupiravir sont des analogues respectivement nucléotidique et nucléosidique de l’ARN polymérase virale ; ces deux produits ont montré des efficacités antivirales très limitées sur le SARS-CoV-2. Le troisième composé représenté par le nirmatrelvir renforcé par le ritonavir11 est un inhibiteur de la protéase principale de différents coronavirus dont le SARS-CoV-2 (Tableau I). En 2022, la Haute Autorité de santé l’a positionné dans le « traitement de la Covid-19 chez les adultes ne nécessitant pas d’oxygénothérapie et ayant un risque élevé d’évolution vers une forme grave de la Covid-19 ». Il est utilisé par voie orale, et ses indications restent limitées par la nécessité d’associer le principe actif au ritonavir susceptible d’interférer avec de nombreux médicaments couramment prescrits chez des patients présentant des comorbidités. Deux revues récentes pointent par ailleurs le risque élevé d’émergence de résistances du SARS-CoV-2 aux antiviraux [30,31].
- Une méta-analyse récente très complète sur les antiviraux actifs sur les virus respiratoires passe en revue les différentes molécules actives sur ces agents et pointe la nécessité de poursuivre les recherches afin d’identifier de nouveaux produits capables d’influer de façon décisive sur le pronostic des infections virales respiratoires graves [32].
Antiviraux actifs sur d’autres familles de virus
En marge des antiviraux décrits dans les chapitres précédents, les recherches vont bon train pour identifier des composés actifs sur des virus émergents comme les arbovirus ou les virus des fièvres hémorragiques virales. À défaut de pouvoir aborder dans le cadre de cette revue toutes ces recherches, nous renvoyons les lecteurs intéressés au site internet de l’Intrepid Alliance, actualisé en avril 2025, qui rapporte les avancées thérapeutiques vis-à-vis de treize familles virales à potentiel pandémique dont cinq familles à transmission respiratoire prédominante (Adenoviridae, Coronaviridae, Orthomyxoviridae, Paramyxoviridae et Picornaviridae) et huit familles transmises par contact ou par des vecteurs (Arenaviridae, Filoviridae, Flaviviridae, Hantaviridae, Nairoviridae, Peribunyaviridae, Poxviridae et Togaviridae) [33].
Étude de la résistance des virus aux antiviraux au laboratoire de microbiologie
Contrairement aux pratiques courantes en bactériologie avec l’antibiogramme, il n’est pas utile, sauf exception, de tester la sensibilité d’un virus responsable d’une infection aux antiviraux en amont de la prescription d’une chimiothérapie antivirale. Cela tient au fait que les tests sont beaucoup plus complexes à effectuer sur le plan technique (et coûteux), que le choix des molécules est beaucoup plus restreint et que les résistances sont inhabituelles à l’instauration du traitement.
Méthodes utilisées pour déterminer la sensibilité des virus aux antiviraux
Deux grands types de méthodes sont utilisés pour étudier la sensibilité des virus aux antiviraux [34] (Figure 4).
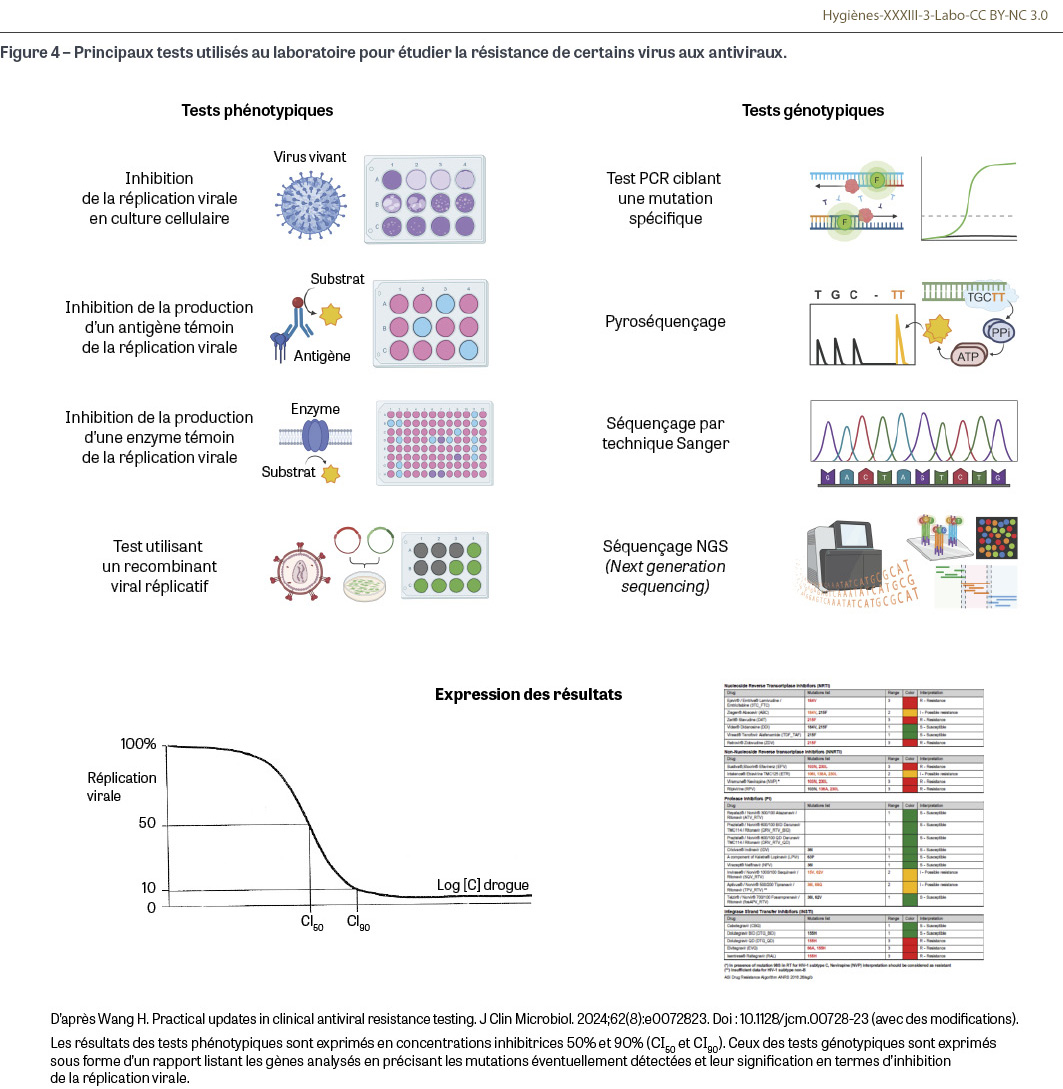
Méthodes phénotypiques
Les méthodes phénotypiques, parfois dénommées antivirogrammes, analysent la capacité de concentrations croissantes d’antiviral à empêcher la multiplication d’un virus. Il est alors possible de tracer des courbes d’inhibition et de déterminer une concentration inhibitrice 50% (CI50) ou 90% (CI90). Différentes méthodes sont utilisées pour suivre l’inhibition de la réplication virale : la réplication virale en culture cellulaire avec dénombrement des plages de lyse et de leur réduction éventuelle en présence de l’antiviral tend à être remplacée par des mesures automatisées de la mort cellulaire (colorants vitaux, chimioluminescence, quantification du génome viral produit par des tests génomiques…) ; la technique immuno-enzymatique mesure indirectement la réplication virale par détection d’antigènes viraux ou d’enzymes virales, la baisse du signal par rapport au témoin sans antiviral permettant d’évaluer l’efficacité du composé. Ces techniques sont essentiellement adaptées à des virus qui se répliquent rapidement en culture cellulaire et notamment au virus herpès simplex, aux virus grippaux ou, plus récemment, au SARS-CoV-2. Pour étudier les résistances in vivo du VIH-1 aux antiviraux, les industriels ont développé un test phénotypique dénommé RVA pour « recombinant virus assay12 » qui permet de disposer d’un virus de laboratoire bien adapté à la culture dans des lymphocytes avec un niveau de réplication élevé (contrairement à celui des isolats primaires) dont on a délété le gène d’intérêt (par exemple celui de la transcriptase inverse) pour le remplacer par celui de la souche de patient pour laquelle on suspecte une résistance, le résultat étant obtenu par simple test PCR13. En comparant la réplication du virus recombinant à celle du virus contrôle en présence de l’antiviral (dans cet exemple, un inhibiteur de la transcriptase inverse), on peut déterminer si le virus du patient est sensible ou résistant à cet antiviral. Cette dernière technique, qui se pratique en zones de confinement de niveau L3, est réservée à des laboratoires de référence ou de recherche, notamment dans le cadre d’essais cliniques de nouveaux antirétroviraux.
Méthodes génotypiques
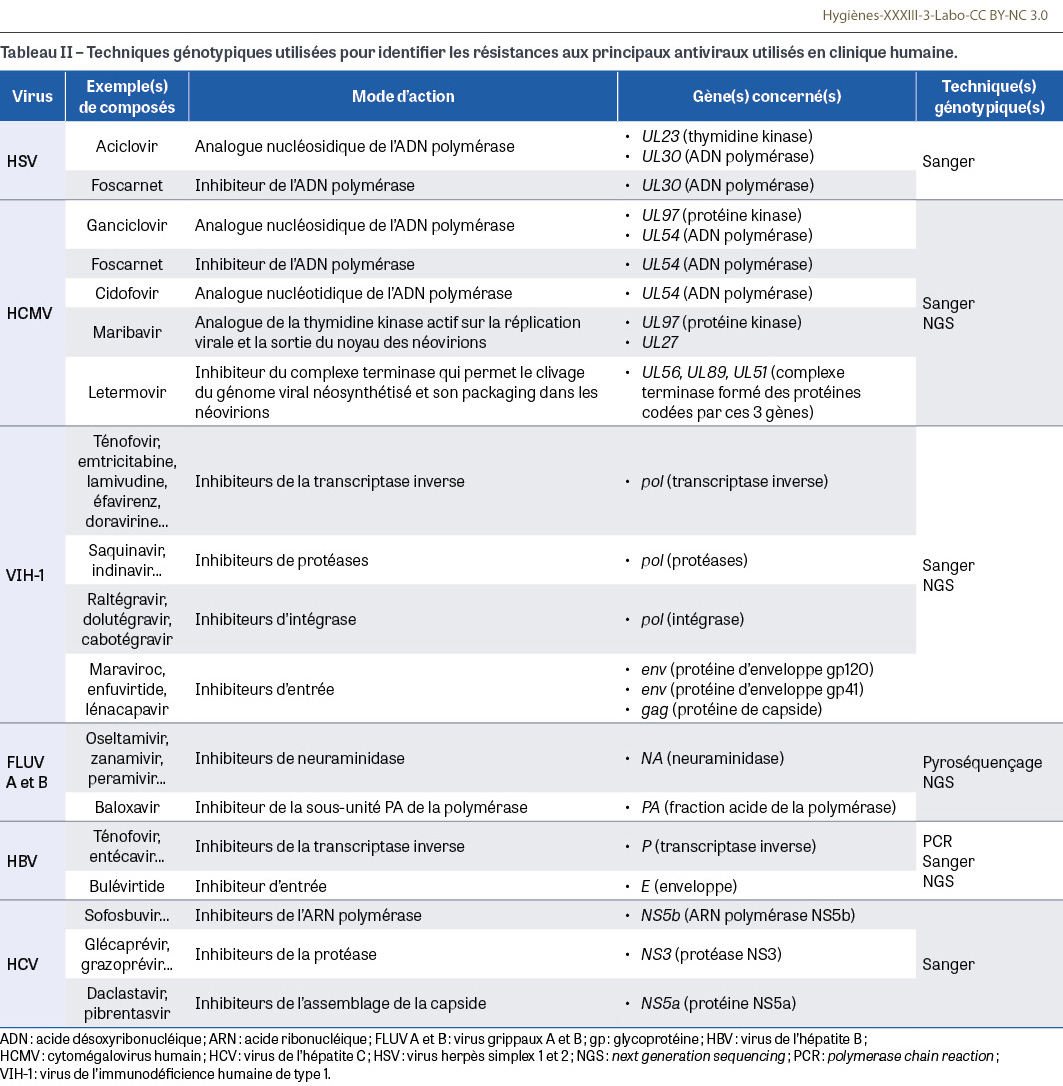
La plupart des laboratoires utilisent désormais des méthodes génotypiques qui recherchent des mutations de résistance au niveau des gènes d’intérêt (Tableau II). Ces méthodes nécessitent en amont la création de bases de données répertoriant les mutations prédictives d’une résistance, ce qui justifie le maintien par les laboratoires spécialisés de tests phénotypiques permettant de confirmer l’impact de la mutation sur la réplication virale. Quand la mutation d’intérêt est parfaitement identifiée, un simple test PCR au sein du gène d’intérêt peut suffire mais ces situations restent exceptionnelles. Dans la majorité des cas, ce sont les techniques de séquençage qui sont utilisées, soit en ciblant un ou plusieurs gènes par la technique de Sanger, par pyroséquençage ou par techniques NGS (next generation sequencing) de deuxième génération, soit en séquençant le génome viral entier par NGS de deuxième (séquençage séquentiel) ou de troisième génération (séquençage en temps réel sur molécule unique). Le Tableau 2 présente les techniques génotypiques actuellement proposées pour dépister les principales mutations de résistance aux antiviraux utilisés pour traiter les infections dues à HSV, à HCMV, à VIH-1, aux virus grippaux A et B, à HBV et à HCV. Le détail des principales mutations d’intérêt pour les différents virus sort du cadre de cet article, pour plus d’informations, le lecteur intéressé peut se reporter à la mise à jour de Wang [34].
Indications des recherches de résistance aux antiviraux en pratique clinique
Comme rappelé au début de ce chapitre, les antiviraux sont habituellement prescrits sans faire de recherche de résistances. Pour certains virus comme VIH-1, HBV ou HCV, l’efficacité du traitement peut être contrôlée par la négativation de la charge virale, toute ré-ascension durable et significative de la charge virale devant faire suspecter l’émergence d’une résistance. Il en est de même en cas d’absence de négativation de la charge virale malgré des posologies adéquates et une bonne observance thérapeutique du patient. Ces observations doivent conduire à la réalisation de tests de résistance génotypiques permettant d’ajuster le traitement et de contrôler son efficacité par de nouvelles mesures de charge virale à distance. Tout traitement antiviral au long cours doit faire l’objet de contrôles réguliers pour vérifier l’indétectabilité de la charge virale. Dans le cas de l’hépatite C, la charge virale doit être contrôlée six mois et douze mois après l’arrêt du traitement antiviral ; en cas de résultat négatif douze mois après l’arrêt du traitement, le patient est considéré comme guéri sur le plan virologique et ne doit plus être recontrôlé (même si un suivi hépatique peut être nécessaire en cas de stigmates de cirrhose) ; par ailleurs, des réinfections peuvent survenir avec un virus appartenant à un autre génotype si l’exposition au risque se poursuit (cas par exemple des toxicomanes non sevrés). Une absence de succès thérapeutique au cours d’une infection virale, notamment chez les patients immunodéprimés ou transplantés (organe ou moelle), doit également conduire à réaliser des tests de résistance. La mise en évidence de mutations de résistance permet de proposer une alternative thérapeutique. En absence de résistance, il convient de vérifier la posologie et l’absence d’interaction médicamenteuse ; il faut également s’assurer de l’observance du patient, en particulier par des dosages pharmacologiques d’antiviraux. Une des rares situations pour lesquelles il est légitime de faire une recherche de résistance avant d’instaurer un traitement antiviral est la découverte récente d’une primo-infection à VIH-1. En effet, le sujet peut avoir été contaminé par un virus résistant, avec le risque d’échec thérapeutique si une trithérapie anti-VIH-1 standard est prescrite.
Conclusion
Même si la vaccination, quand elle est disponible, représente la stratégie la plus efficace pour contrôler les infections virales, le développement exponentiel de la chimiothérapie antivirale au cours des soixante dernières années a permis des succès thérapeutiques considérables dans des domaines pathologiques multiples. Contrairement aux antibiotiques, les antiviraux résistent à l’épreuve du temps et conservent une efficacité remarquable malgré l’émergence ponctuelle de mutants résistants, qui ont l’avantage de disparaître assez rapidement lorsque l’exposition à la molécule responsable cesse. Une autre différence remarquable entre les antibiotiques et les antiviraux est l’efficacité de ces derniers à titre préventif, comme le montrent les expériences avec la PrEP anti-VIH ou la prévention des infections à RSV chez les nourrissons. Les progrès spectaculaires de la pharmacologie font espérer d’autres succès dans le domaine des viroses émergentes (arboviroses, fièvres hémorragiques virales, infections respiratoires graves…). Le laboratoire de microbiologie joue un rôle central en contrôlant l’efficacité des traitements antiviraux et en dépistant les résistances heureusement assez peu fréquentes. Avec le progrès des méthodes génotypiques et l’appoint d’algorithmes générés par l’intelligence artificielle, il est vraisemblable que la chimiothérapie antivirale continuera à jouer un rôle déterminant dans les défis virologiques de demain.
Notes :
1- Administration des denrées alimentaires et des médicaments.
2- La liste complète des composés antiviraux enregistrée par la FDA-US est disponible en annexe pour information.
3- VIH : virus de l'immunodéficience humaine.
4- ADN : acide désoxyribonucléique ; ARN : acide ribonucléique.
5- Sur les 55 antirétroviraux enregistrés à l’US-FDA, 23 concernent des spécialités combinées. Depuis 2000, la tendance s’est encore accélérée avec 22 spécialités combinées sur 40 antirétroviraux enregistrés (voir annexe I).
6- Pour pre-exposure prophylaxis.
7- NS : [protéine] non structurelle.
8- Polymerase acid.
9- Coronavirus disease 2019, maladie à coronavirus 2019.
10- Severe acute respiratory syndrome coronavirus 2, coronavirus 2 du syndrome respiratoire aigu sévère.
11- Commercialisé sous le nom de Paxlovid®.
12- Test de virus recombinant.
13- Polymerase chain reaction.