Introduction
Pour ce nouveau volet de la rubrique Du côté du labo, nous allons faire le point sur le diagnostic et la prise en charge en termes de prévention de la transmission par les patients atteints de diarrhées à Clostridioides difficile. En effet, bien que cette pathologie soit connue depuis de nombreuses années, des changements sont survenus dans de nombreux domaines de la maladie qui peuvent influencer au quotidien l’action des hygiénistes. Cette brève revue propose une actualisation d’un sujet très important pour la prise en charge des patients hospitalisés.
Évolution taxonomique
Au regard de nouvelles analyses phylogénétiques et phénotypiques, l’espèce Clostridium difficile a été reclassée en 2016 en Clostridioides difficile [1].
Épidémiologie des infections à C. difficile
C. difficile est responsable de 10% à 25% des diarrhées qui surviennent au cours ou au décours d’une antibiothérapie et de pratiquement tous les cas de colites pseudomembraneuses (CPM) qui sont diagnostiquées lors de l’examen endoscopique. L’incidence des infections à C. difficile (ICD) est en augmentation depuis le début des années 2000. En France, l’incidence des séjours hospitaliers mentionnant un diagnostic d’ICD est passée de 1,5 séjour pour 10 000 journées d’hospitalisation en 2010 à 3,4 en 2016, soit 14% d’augmentation par an [2]. Les infections digestives étaient classées à la sixième place des infections nosocomiales lors de l’enquête nationale de prévalence réalisée en 2022 avec une prévalence de 0,32% (pour une prévalence globale des infections nosocomiales de 6,06%) [3]. Lors de cette enquête, C. difficile se hissait au dixième rang des micro-organismes responsables d’une infection associée aux soins avec une part relative de 2,32%. Le rôle pathogène de C. difficile chez l’enfant est discuté. Le pourcentage d’enfants porteurs asymptomatiques de souches toxinogènes ou non est très élevé avant trois ans et peut atteindre 70% [4].
L’origine communautaire ou associée aux soins n’est pas simple à déterminer et fait encore l’objet de discussions [5]. Le caractère nosocomial des ICD est retenu si les symptômes apparaissent au moins 48 heures après l’admission, au cours de l’hospitalisation et dans les quatre semaines qui suivent la sortie de l’hôpital. Les infections sont considérées comme communautaires si elles surviennent à une distance minimale de douze semaines après toute hospitalisation. En dehors de ces périodes, l’origine nosocomiale ou communautaire est discutée. La place de C. difficile au sein des micro-organismes responsables de diarrhées en dehors de l’hôpital est probablement sous-évaluée.
Dans une étude multicentrique réalisée pendant onze mois en 2019 auprès de quinze laboratoires d’analyse médicale privés, la recherche de la toxine de C. difficile avait été systématiquement réalisée lorsqu’une coproculture était prescrite [6]. Cette recherche s’est avérée positive chez 1,81% des patients de plus de trois ans. C. difficile était dans cette étude le second entéropathogène identifié après Campylobacter sp. Sa recherche n’était pourtant spontanément demandée par les prescripteurs que dans 13% des cas (52,3% des recherches positives) [6].
Les recommandations de la Société européenne de microbiologie clinique et de maladies infectieuses (ESCMID) de 2016 stipulent qu’il faudrait rechercher C. difficile devant tout cas de selle diarrhéique chez l’adulte [7]. La Haute Autorité de santé souligne que sa recherche doit être réalisée dans les situations suivantes : diarrhée communautaire persistante et sans amélioration au-delà de trois jours malgré le traitement symptomatique, ou associée d’emblée à des signes de gravité, avec ou sans antibiothérapie [8].
Pouvoir pathogène de C. difficile
Le pouvoir pathogène de C. difficile est lié à la présence de toxines : la toxine A, ou entérotoxine, et la toxine B, ou cytotoxine. Les toxines A et B sont codées par les gènes tcdA et tcdB1. Elles sont capables de détruire les entérocytes et de provoquer une réaction inflammatoire au niveau de la muqueuse. Une autre toxine, la toxine binaire, a été décrite. Son rôle pathogène spécifique est discuté, comme sa participation à l’exacerbation de la pathogénicité de certains clones particulièrement virulents (cf. ci-dessous). Une souche de C. difficile dite non toxinogène (absence des toxines A et B) n’est pas considérée comme pathogène si elle est retrouvée dans les selles.
La résistance naturelle de C. difficile à de nombreux antibiotiques (dont les céphalosporines) favorise sa prolifération intestinale lors d’une antibiothérapie ayant notamment une action sur le microbiote dominant anaérobie.
Le rôle pathogène de C. difficile et sa transmissibilité, sont liés à la formation de spores qui sont capables de persister pendant des mois sur des supports inertes. Ces structures quiescentes (insensibles aux traitements antibiotiques car ne se multipliant pas) résistent particulièrement bien aux écarts de température, à l’absence de nutriment, à la dessiccation, aux désinfectants couramment utilisés, aux antiseptiques comme l’alcool, ou aux produits hydro-alcooliques utilisés pour l’hygiène des mains. Seules la détersion ou l’utilisation de produits spécifiés comme sporicides permettent de les détruire.
À la fin des années 1990 a été rapportée dans différents pays une augmentation des cas d’infections à C. difficile et de leur gravité [4]. L’étude moléculaire des souches a permis d’identifier un clone (ribotype) particulier caractérisé par sa résistance de haut niveau aux fluoroquinolones, la présence d’une troisième toxine (la toxine binaire) et une production augmentée des toxines A et B. Ces caractéristiques permettaient d’expliquer à la fois la gravité des cas et la très forte excrétion de spores dans l’environnement à l’origine de nombreuses transmissions secondaires. La diffusion rapide de ce clone (dénommé NAP-12 ou ribotype 027) s’est arrêtée dans les décennies suivantes sans explication ; des souches appartenant à ce clone sont néanmoins toujours identifiées sporadiquement en France.
Les infections à C. difficile sont également caractérisées par un taux de récidive élevé, notamment lorsque les causes initiales de l’infection (utilisation d’antibiotiques, altération du microbiote intestinal…) ne sont pas corrigées.
Diagnostic au laboratoire des diarrhées à C. difficile
Les techniques diagnostiques et notamment les algorithmes qui précisent les différentes étapes du diagnostic biologique des diarrhées à C. difficile ont régulièrement évolué au cours des vingt dernières années. La démocratisation des techniques de PCR3 et la désormais large utilisation des tests génomiques dits syndromiques combinant la recherche simultanée des acides nucléiques de différents agents pathogènes (bactéries, virus, toxines et parasites) ont bouleversé l’approche diagnostique.
Indication de la recherche de C. difficile dans les selles
C. difficile reste en 2024 la principale bactérie responsable de diarrhée nosocomiale. Il est donc justifié de rechercher cette étiologie dans un contexte d’hospitalisation. Néanmoins il est plus que jamais nécessaire de rappeler au prescripteur la définition de la diarrhée aiguë : présence quotidienne d’au moins trois selles non moulées depuis moins de quinze jours. Les diarrhées chroniques qui datent de plus de quinze jours ont d’autres étiologies. La présence d’un seul épisode diarrhéique ne doit pas déclencher un prélèvement microbiologique à visée diagnostique : s’il met en évidence C. difficile ou sa toxine, il n’est pas certain que cette présence soit responsable des symptômes ; le patient est le plus souvent un simple porteur et ces diagnostics excessifs sont à l’origine de traitements antibiotiques non justifiés. De nombreuses études ont montré l’intérêt de la juste prescription de la recherche de C. difficile [9]. Si la diarrhée aiguë est avérée, la responsabilité de C. difficile doit être recherchée, notamment en cas d’antibiothérapie ou d’hospitalisation récente.
Types de prélèvement
Le principal prélèvement biologique testé est constitué par des selles non moulées (c’est-à-dire prenant la forme du récipient). En milieu hospitalier, elles ne sont quasiment plus envoyées directement au laboratoire mais sont échantillonnées par l’infirmière à l’aide d’un écouvillon déchargé immédiatement dans un milieu de transport. Cette organisation empêche le contrôle de l’aspect des selles au laboratoire. Ce milieu de transport doit être conservé à température ambiante le temps d’être acheminé au laboratoire (le délai d’envoi est généralement de 24 heures et peut aller jusqu’à trois jours). De façon anecdotique, C. difficile peut également être recherché à partir de biopsies digestives conservées dans quelques gouttes de sérum physiologique stérile.
Techniques microbiologiques
L’intitulé de la demande stipule la recherche de C. difficile et de ses toxines dans les selles. Il est très important de noter que la recherche de C. difficile n’est pas incluse dans la coproculture standard qui comprend la recherche de Salmonella, Shigella et Campylobacter. Cette nomenclature étant souvent à l’origine de prescriptions erronées, de nombreux laboratoires hospitaliers transforment automatiquement les demandes de coproculture standard en demandes de recherche de C. difficile si le patient est hospitalisé depuis 48 ou 72 heures. En effet, si le patient est admis pour un autre motif qu’une infection digestive, il est peu probable qu’il développe au cours de son hospitalisation une diarrhée infectieuse liée aux pathogènes communautaires recherchés dans le cadre de la coproculture standard. À l’inverse, C. difficile étant la principale bactérie responsable de diarrhée nosocomiale, elle doit être recherchée par principe dans ce contexte d’apparition de symptômes digestifs au cours d’une hospitalisation. Cette approche doit néanmoins tenir compte du risque d’acquisition de bactéries communautaires en cas de permission accordée aux patients, d’apport d’aliments par la famille ou, phénomène plus récent, de livraison d’aliments à l’intérieur de l’hôpital. En raison de leur mauvaise valeur prédictive dans un contexte de faible incidence d’ICD, les tests commerciaux actuellement disponibles ne peuvent pas être utilisés seuls. C’est pourquoi l’ESCMID recommande au niveau européen un algorithme diagnostique en deux étapes afin d’optimiser le diagnostic des ICD [7].
Place de la culture : l’exception C. difficile
Contrairement à l’usage pour la majorité des bactéries recherchées au laboratoire, la culture bactérienne n’est pas la technique de référence pour C. difficile. Il y a plusieurs raisons à cela : tout d’abord, comme vu précédemment, seules les souches de C. difficile productrices de toxines sont pathogènes et doivent être recherchées. De plus, C. difficile est une bactérie anaérobie du tube digestif dont la culture nécessite des conditions particulières pour éliminer l’oxygène mais aussi éviter la prolifération des autres bactéries du tube digestif, qui se reproduisent plus vite et plus facilement et pourraient masquer la présence de C. difficile. Il faut donc utiliser des milieux sélectifs contenant des antibiotiques inhibant les autres micro-organismes, incubés au minimum 48 heures en anaérobiose. Des milieux chromogéniques ont été développés pour faciliter l’identification des colonies suspectes qui présentent une couleur particulière (Figure 1). De plus, si C. difficile est présent sous la forme de spores, il faut que celles-ci germent pour pouvoir donner des colonies identifiables : certains milieux favorisent cette germination en intégrant des additifs comme les sels biliaires. La culture des selles à la recherche de C. difficile n’est donc pas mise en œuvre en première intention mais uniquement lorsque les autres tests développés ci-dessous sont positifs. L’isolement de la souche permet, le cas échéant, de la comparer à d’autres souches pour rechercher des phénomènes de transmissions croisées et donc des épidémies. Cette culture n’est néanmoins pas systématiquement réalisée par les laboratoires. L’exception à cette règle est la recherche de C. difficile à partir de biopsies digestives qui doivent être mises en culture ; en cas de culture positive, les souches de C. difficile sont ensuite testées pour rechercher la présence de toxines.
Détection antigénique
Comme nous l’avons souligné précédemment, la présence d’une souche toxinogène, si elle n’est pas suffisante, est nécessaire au diagnostic de diarrhées à C. difficile. Les stratégies diagnostiques ont donc intégré un premier tri des échantillons de selles par la recherche d’un antigène spécifique de cette bactérie. Il s’agit d’une enzyme, la glutamate déshydrogénase (GDH), qui est recherchée par une méthode immuno-enzymatique ou immunochromatographique. Cette analyse est très sensible : en cas de négativité, la recherche de C. difficile peut être considérée comme négative. En cas de positivité, il est néanmoins indispensable de rechercher la présence des toxines afin de mettre en évidence les souches de C. difficile toxinogènes, les seules dotées de pouvoir pathogène, et notamment responsables de diarrhées.
Détection des toxines dites « libres »
La présence de toxines libres dans les selles est recherchée dans le prélèvement par une méthode immuno-enzymatique ou immunochromatographique ; ce sont des méthodes phénotypiques qui mettent en évidence la toxine en tant que protéine. La présence de ces toxines dites « libres » atteste d’une infection digestive à C. difficile. La spécificité de ces tests est excellente, néanmoins leur sensibilité est imparfaite. L’association entre un test antigénique GDH positif et une recherche de toxine libre négative peut avoir deux explications : la présence d’une souche de C. difficile non toxinogène donc non pathogène, ou la présence d’une souche produisant une toxine en quantité non suffisante pour être mise en évidence par les techniques phénotypiques. Des tests complémentaires sont donc nécessaires pour statuer.
Tests combinant recherche antigénique et recherche de la toxine libre
Certains tests appelés « combo » combinent sur le même support appelé cassette la recherche de la GDH et celle des toxines libres (Figure 2).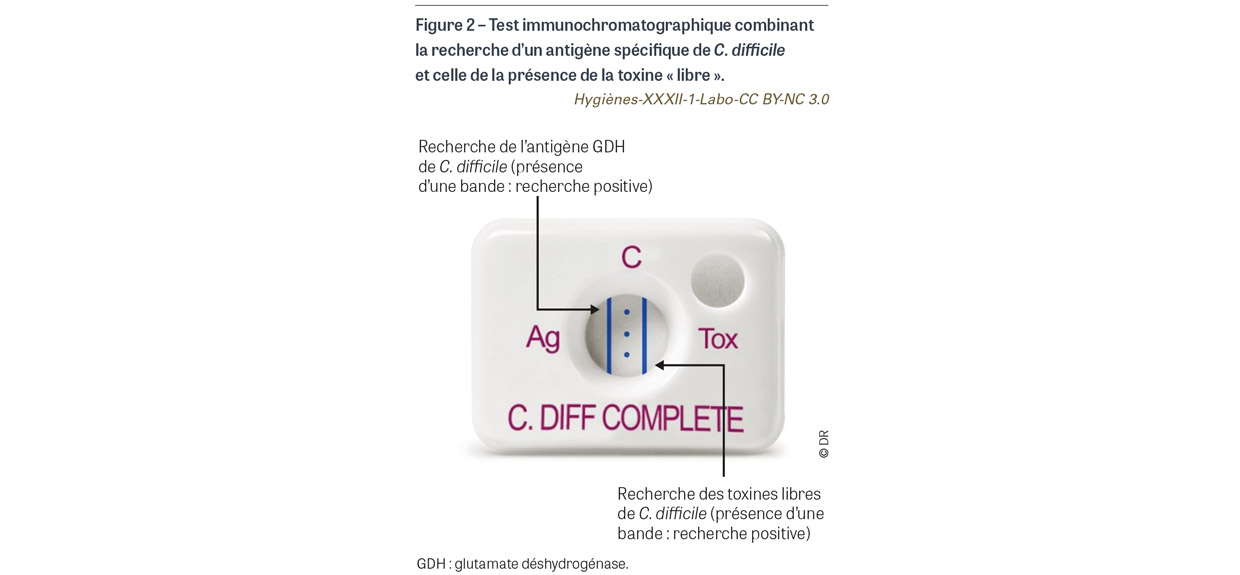
Tests d’amplification génique par méthode PCR
Tests PCR ciblant uniquement C. difficile
La recherche de toxine de C. difficile peut se faire par PCR ciblant les gènes codant les toxines. Ce sont des tests génotypiques très sensibles qui mettent en évidence les gènes recherchés sans néanmoins pouvoir attester de leur expression. Leur utilisation au début des années 2000 a été responsable, au moins en partie, d’une augmentation des cas diagnostiqués dans de nombreux pays sans qu’il soit possible de faire la part entre le diagnostic de nouvelles infections et l’augmentation de la détection du portage asymptomatique de souches toxinogènes (Encadré). Certains tests PCR commercialisés sont complètement automatisés (extraction, amplification et révélation). Certaines trousses commerciales recherchent également d’autres cibles comme la toxine binaire, ou permettent l’identification présomptive du clone 027.
Panels de tests PCR ciblant plusieurs pathogènes digestifs dont C. difficile
Nous avions évoqué, dans un précédent numéro de cette rubrique, les panels syndromiques qui combinent dans une même réaction PCR plusieurs cibles bactériennes, virales ou parasitaires adaptées à un contexte pathologique particulier (diarrhée, infection respiratoire, infection sexuellement transmissible, méningite…), d’où le terme « panel syndromique » [10]. Au sein des panels gastro-intestinaux, la recherche des toxines de C. difficile est très souvent incluse.
Autres tests
La méthode historique de référence pour la détection des toxines libres (test de cytotoxicité sur culture cellulaire) n’est plus utilisée en dehors des centres de référence.
Algorithme diagnostique
Plusieurs algorithmes décisionnels ont été validés par les sociétés savantes lorsqu’une demande de recherche de toxine de C. difficile est prescrite [8,11]. Le premier algorithme est constitué de trois étapes : recherche de GDH puis, en cas de recherche positive, recherche de toxines libres par test immunochromatographique ou immuno-enzymatique puis, si ce second test est négatif, recherche des gènes de toxines par PCR (Figure 3a). Un second algorithme en deux étapes est également possible : recherche combinée de la GDH et de la toxine libre par un test « combo » puis en cas de discordance (GDH présente et toxine libre absente) ; puis recherche des gènes de toxines par PCR (Figure 3b). Enfin, certains laboratoires utilisent en première intention un test PCR et recherchent ensuite la présence de toxines libres en cas de PCR positive.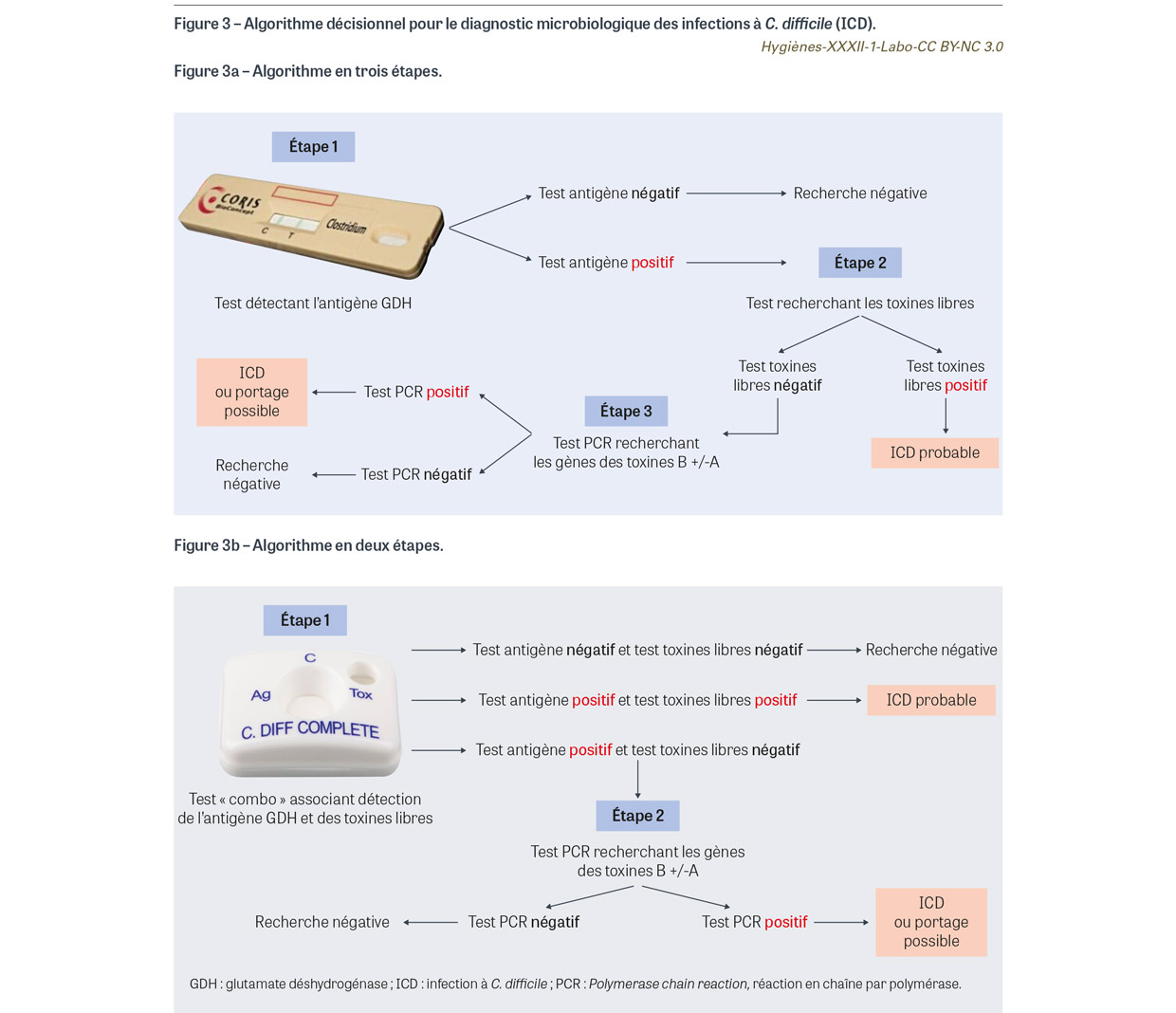
Interprétation des résultats
Les trois cas de figure les plus simples sont les suivants :
- Test GDH négatif, ou test combinant GDH et toxines libres négatif : l’hypothèse diagnostique d’infection à C. difficile est écartée. Il n’y a pas lieu de répéter la demande dans les sept jours qui suivent mais de rechercher une autre cause infectieuse (virale notamment) ou non.
- Test GDH positif et recherche de toxines libres positive : l’hypothèse d’une infection digestive à C. difficile est très probable.
- Test GDH positif, recherche phénotypique de toxines libres négative mais présence des gènes codant les toxines par les techniques de PCR. C’est la situation discordante la plus fréquente, à l’origine de deux hypothèses diagnostiques diamétralement opposées : simple portage de C. difficile toxinogène en faible quantité qui ne serait pas responsable des symptômes observés ; authentique infection digestive à C. difficile mais dont la quantité de toxine libre présente dans le prélèvement n’est pas suffisante pour être détectée par les techniques phénotypiques. Le choix entre ces deux hypothèses doit se faire après discussion entre clinicien prenant en charge le patient, microbiologiste et infectiologue en fonction du contexte clinique et notamment des facteurs de risque (antibiothérapie, antécédent d’infection à C. difficile…) et de la présence d’autres causes pouvant expliquer les symptômes (Encadré).
Encadré – Quelle évolution et quelle prise en charge des patients porteurs asymptomatiques ?
Le portage de C. difficile toxinogène est défini par la présence d’une souche toxinogène chez un patient ne présentant pas ou plus de symptôme. La notion de portage de souche de C. difficile toxinogène chez des patients asymptomatiques était surtout connue pour des enfants de moins d’un an. L’utilisation à large échelle de tests PCR très sensibles a néanmoins mis en évidence ce phénomène chez un nombre non négligeable de patients adultes. Deux études multicentriques françaises ont montré que la prévalence de C. difficile toxinogène variait de 3,9% à 5,8% ; parmi les patients porteurs, une minorité présentait une recherche de toxine libre positive, les autres présentaient un profil de type « présence de GDH1 – absence de toxine libre – PCR2 positive » [20,21].
La prévalence du portage variait selon le type de service et était plus élevée dans les services de long séjour que dans les services de chirurgie.
Les facteurs de risque de portage étaient une antibiothérapie dans les trois mois précédents, une hospitalisation dans les deux mois précédents, une durée d’hospitalisation cumulée plus élevée avant le dépistage et une hospitalisation dans un service avec une incidence élevée d’infection à C. difficile. Dans une étude américaine réalisée dans une réanimation pendant neuf mois, 9,3% des patients admis étaient porteurs d’une souche toxinogène à l’admission [17]. Seuls 1% des patients non porteurs à l’admission ont acquis une souche au cours de leur hospitalisation ; en parallèle, les patients porteurs avaient 24 fois plus de risque de développer une infection au cours de leur hospitalisation que les non-porteurs.
Au quotidien, l’hygiéniste doit de plus en plus souvent faire face à la gestion de patients présentant des tests discordants (présence de l’antigène GDH, absence de toxine libre, gènes de toxines détectés par PCR) ou de patients naturellement guéris et ne présentant plus de symptôme au moment où les résultats des tests positifs sont transmis aux équipes opérationnelles d’hygiène. Du point de vue de l’hygiéniste, il nous semble logique de :
- mettre en place des précautions complémentaires adaptées pour les patients présentant de la diarrhée et des tests discordants, au minimum le temps que la discussion clinico-biologique et la recherche d’autres causes possibles statuent sur le cas, ce qui est cohérent avec les dernières recommandations nord-américaines de 2022 [9] ;
- maintenir en chambre individuelle, si possible, les patients asymptomatiques porteurs de souche de C. difficile toxinogène, notamment s’ils doivent bénéficier d’une antibiothérapie puisque la probabilité pour ces patients de développer une infection est particulièrement élevée.
Notes :
1- GDH : glutamate déshydrogénase.
2- PCR : Polymerase chain reaction, réaction en chaîne par polymérase.
Il existe d’autres profils de réponse plus rares :
- Test GDH et toxines libres négatifs et PCR pour la recherche de toxine positive (notamment lorsqu’un panel syndromique est réalisé en parallèle d’une recherche isolée de C. difficile) sans que l’on sache quel test doit être considéré in fine.
- Tests PCR discordants (PCR ciblant isolément l’ADN4 de C. difficile négative et PCR du panel positive, ou inversement). Les différents tests PCR n’ayant pas les mêmes caractéristiques techniques, leurs performances et notamment leur sensibilité et leur spécificité peuvent en effet varier (les tests isolés sont parfois plus sensibles).
Dans ces situations inhérentes à la multiplication des tests pour une même analyse, une discussion clinico-biologique est là aussi indispensable pour interpréter ces résultats discordants.
Prise en charge thérapeutique
Le traitement des infections à C. difficile a évolué, privilégiant l’utilisation de fidaxomicine ou de vancomycine par rapport au traitement « historique » par le métronidazole [12]. Au-delà de l’efficacité du traitement sur l’épisode en cours, il est important d’évaluer sa capacité à éviter les récidives. D’autres solutions pour limiter la survenue de ces récidives sont désormais disponibles ou sur le point d’être commercialisées : perfusion d’anticorps antitoxine, greffe fécale à partir de selles de donneur sains, cocktails bactériens…
Antibiogramme : une autre exception propre à C. difficile
De manière inattendue, le choix de la molécule à utiliser pour traiter les infections digestives à C. difficile n’est pas basé sur l’évaluation in vitro de la sensibilité de la souche aux antibiotiques par la réalisation systématique d’un antibiogramme [13]. L’infection étant intra-intestinale, la majorité des molécules utilisées (vancomycine, fidaxomicine) ne passent pas la barrière intestinale et par conséquent ne se retrouvent pas dans le sang. Les concentrations minimales inhibitrices qu’il est néanmoins possible de mesurer devraient donc être interprétées en fonction des concentrations d’antibiotiques atteignables à l’intérieur du tube digestif. Le comité de l’antibiogramme de la Société française de microbiologie ne donne pas de concentration critique pour évaluer la sensibilité des souches de C. difficile à la fidaxomicine, alors qu’au niveau européen une valeur a été établie [14,15]. Concernant la sensibilité au métronidazole ou à la vancomycine, les résistances sont parfois dues à des aléas techniques comme la qualité de l’anaérobiose pour le métronidazole. Des souches de sensibilité diminuée à ces molécules ont été exceptionnellement isolées dans des contextes cliniques particuliers ; elles doivent faire l’objet d’une expertise par un centre de référence. Il est admis qu’à ce jour il n’y a pas de corrélation directe entre la sensibilité évaluée in vitro et l’évolution clinique [15]. L’intérêt de ces antibiogrammes est donc discutable.
Mise en place des précautions complémentaires en cas de recherche positive
Dès la suspicion d’une diarrhée à C. difficile, des précautions complémentaires spécifiques doivent être mises en œuvre : chambre individuelle avec toilettes privatives, port de gants et d’une surblouse à usage unique, élimination des excreta en tant que déchets d’activité de soins à risque infectieux (Dasri), association de la friction hydro-alcoolique et du lavage simple pour l’hygiène des mains, bionettoyage de l’environnement à l’aide d’une solution désinfectante sporicide. Ces mesures peuvent être levées 48 heures après la disparition des symptômes, indépendamment de la durée du traitement antibiotique prescrit. Il est recommandé de ne pas contrôler microbiologiquement la guérison : en effet les tests peuvent rester positifs alors que le risque de contamination lié notamment aux symptômes est contrôlé 48 heures après la disparition de ces symptômes [9]. L’identification présomptive d’un clone particulier (ribotype 027 par exemple) par certaines trousses génomiques ciblant C. difficile ne justifie pas plus qu’une surveillance renforcée de l’observance des mesures habituelles.
Place de la transmission croisée en milieu hospitalier
La survenue d’une infection à C. difficile peut avoir plusieurs origines. Elle est initialement liée à une altération du microbiote intestinal qui ne joue plus suffisamment son rôle de « barrière » vis-à-vis de la présence de spores d’une souche toxinogène de C. difficile dans le tube digestif, qui vont germer. L’origine de ces spores est multiple :
- présence préalable dans le tube digestif : c’est alors une infection endogène d’un patient initialement « porteur sain » ;
- contamination à partir de spores présentes dans l’environnement. À l’hôpital, les porteurs asymptomatiques ou les patients symptomatiques non diagnostiqués peuvent contaminer parfois massivement l’environnement par des spores habituellement résistantes aux désinfectants utilisés en routine (ammoniums quaternaires…). Le bionettoyage de l’environnement autour de cas diagnostiqués peut également être incomplet. Il est bien établi dans la littérature que la probabilité de développer une infection à C. difficile est plus importante lorsqu’un patient est admis dans une chambre ayant abrité un patient infecté par C. difficile que quand ce n’est pas le cas [16] ;
- transmission croisée entre deux patients par l’intermédiaire des mains des soignants ou du matériel partagé ;
- contamination par l’alimentation. Des souches de C. difficile toxinogène ont été retrouvées dans différents aliments, y compris en France.
Une étude récente basée sur le séquençage complet du génome de toutes les souches isolées dans un service de réanimation pendant neuf mois, y compris celles des porteurs asymptomatiques, a montré que le nombre de patients qui acquéraient une souche de C. difficile au cours de leur hospitalisation par transmission croisée était de l’ordre de 1% [17]. Les auteurs soulignaient que cela confortait l’efficacité des mesures actuellement recommandées pour limiter la transmission croisée.
Dépistage des patients porteurs de souches de C. difficile toxinogène à l’admission
À ce jour, le dépistage des patients asymptomatiques n’est recommandé par aucune société savante. La gestion d’un nombre de patients porteurs probablement non négligeable n’est pas codifiée par des études scientifiques tranchées, ce qui serait par ailleurs à l’origine d’une augmentation importante de patients en précautions complémentaires sans qu’un bénéfice collectif ne soit établi [9].
Décontamination de l’environnement
La présence de spores, forme de résistance particulièrement efficace vis-à-vis des désinfectants habituellement utilisés, nécessite l’utilisation de composés chimiques spécifiques. Les molécules sporicides utilisées pour la désinfection de l’environnement sont dérivées du chlore ou de peroxydes comme l’acide peracétique. Une nouvelle version de la norme visant à tester l’efficacité des formulations revendiquant une efficacité contre les spores de C. difficile a amené les fabricants à augmenter les concentrations ou les durées d’action. D’un point de vue pragmatique, ces mesures sont très importantes à la sortie du patient, moment où la durée d’application du désinfectant dans la chambre n’est plus un facteur limitant son efficacité. Concernant les lingettes revendiquant une activité sporicide, il est probable que celle-ci soit due à l’effet d’essuyage plus qu’à une efficacité sporicide intrinsèque. Ces dispositifs sont néanmoins intéressants pour la désinfection du petit matériel qui ne peut pas être dédié à l’intérieur des chambres de patients infectés et qui ne supporte pas l’utilisation de désinfectants à base d’eau de Javel ou d’acide peracétique. L’eau de Javel, correctement diluée, conservée et utilisée, reste un désinfectant peu onéreux et très efficace. Une étude publiée récemment avait remis en cause son efficacité sur différentes souches de C. difficile [18]. Le comité scientifique de la Société française d’hygiène hospitalière et le centre national de référence de C. difficile y ont répondu conjointement en soulignant les limites, les biais et les incohérences de cet article [19].
Autres micro-organismes responsables de diarrhées nosocomiales
Au-delà de C. difficile, il est important de noter que certains virus sont responsables de diarrhées nosocomiales, notamment en période d’épidémies hivernales. Ce sont principalement des norovirus, mais aussi des sapovirus, adénovirus ou rotavirus. Leurs présentations cliniques (présence de vomissement), l’allure fortement épidémique qu’il est parfois possible de qualifier d’explosive et la présence de cas secondaires chez les soignants permettent de s’orienter vers des tests moléculaires ou antigéniques ciblant les norovirus, ou vers des panels syndromiques regroupant différents pathogènes digestifs dont les virus.
Conclusion
Lors de la dernière enquête nationale de prévalence, 16,24% des patients hospitalisés un jour donné en France bénéficiaient d’un traitement par antibiotique à usage systémique, chiffre en augmentation de 7,5% par rapport à l’enquête précédente [3]. Les infections à C. difficile constituent donc toujours un risque pour les patients et un sujet d’inquiétude pour les soignants. Les craintes de diffusion de clones particulièrement virulents et transmissibles du début des années 2000 se sont progressivement éloignées. En parallèle, le nécessaire bon usage des antibiotiques qui passe par celui des tests diagnostiques, a amené les microbiologistes à recommander la réalisation des tests uniquement chez les patients suspects d’infection et pas seulement porteurs, et de proposer des algorithmes diagnostiques en plusieurs étapes. Les hygiénistes doivent bien connaître ces différentes situations et contribuer par leur expertise à la gestion du risque de transmission croisée immédiat et à venir.
Notes :
1- Tcd : C. difficile toxin.
2- North American pulsotype 1.
3- Polymerase chain reaction, réaction en chaîne par polymérase.
4- Acide désoxyribonucléique.