Introduction
En France, les infections urinaires associées aux soins (IUAS) sont la première cause d’infection associée aux soins (28%) devant les infections respiratoires (16%) et les infections de site opératoire (14%) [1]. Leur prévalence est stable au cours du temps : 5% en 2017 contre 5,3% en 2022 [1]. La résistance bactérienne est un enjeu majeur de santé publique avec une estimation de 1,27 million de morts dans le monde en 2019. Les projections estiment que la résistance bactérienne deviendrait même la première cause de mortalité en 2050 dans le monde avec dix millions de morts par an [2,3]. Cependant, les conséquences de la résistance sont différentes selon les pays, ceux à revenu faible et intermédiaire, notamment l’Afrique et l’Asie, étant les plus concernés. Au niveau mondial, les infections urinaires sont la quatrième cause de mortalité liée à l’antibiorésistance derrière les pneumonies, les bactériémies, et les infections intra-abdominales [2]. En France, le nombre de décès dus aux bactéries hautement résistantes émergentes (BHRe) et multirésistantes (BMR) était de 4 500 en 2019 [4]. Escherichia coli et Klebsiella pneumoniae sont les deux principales espèces bactériennes responsables d’IUAS en France (environ 60% des IUAS). Toutes infections confondues, la prévalence de la résistance aux céphalosporines de troisième génération (C3G) chez E. coli est plutôt stable en France depuis 2018, de l’ordre de 8%, tandis qu’elle atteint 25% chez Klebsiella pneumoniae [5]. Un des facteurs de risque principaux d’IUAS est le port d’une sonde vésicale (SV) [6,7]. Environ 25% des patients hospitalisés sont porteurs durant leur séjour d’une SV de manière transitoire ou prolongée, ainsi que 10% des patients admis en établissement de long séjour. La colonisation urinaire bactérienne est estimée à 3-10% par jour [8]. La durée de sondage vésical est associée à l’augmentation du risque d’infection urinaire notamment secondaire aux complications mécaniques telle qu’une SV bouchée [7]. Dans les services d’urologie, 60% à 70% des infections associées aux soins sont des infections urinaires, principalement suite à une cystoprostatectomie radicale (57%), une photovaporisation de la prostate (9%), une néphrectomie (8%), ou une résection transurétrale de prostate (7%) [6,9]. Dans cette revue générale, nous commencerons par rappeler les méthodes de prévention qui ont été validées dans la littérature, puis nous discuterons des moyens de prévention en cours de développement.
Moyens de prévention des infections urinaires associées aux soins validés dans la littérature
Limitation des indications de sonde vésicale
Une méthode simple pour prévenir les IUAS est d’éviter de poser une SV. Ainsi, il est bon de rappeler les indications validées de pose de SV, de les réévaluer quotidiennement, de réaliser des audits réguliers et de former les médecins et les infirmières [10,11] (Encadré).
Encadré – Indications de la pose de sonde vésicale [10,11]
- rétention aiguë d’urine ;
- surveillance de diurèse (en cas de coma, sédation, instabilité hémodynamique) ;
- chirurgie (>3 h, urogénitale, ou chirurgie à risque hémorragique pour surveillance de la diurèse) ;
- escarre du sacrum associée à une incontinence urinaire ;
- immobilisation prolongée (même si l’auto ou l’hétérosondage doit être priorisé) ;
- traitement de confort ou de fin de vie.
Alternatives à la sonde vésicale
L’autosondage ou l’hétérosondage lorsqu’il est réalisable sont des alternatives à la SV à demeure et devraient être envisagés en priorité. Ils nécessitent cependant une formation spécifique et du matériel adapté. Un autre moyen de prévention est de remplacer la SV par un système de récupération des urines moins invasif, évitant ainsi le contact entre la sonde et la vessie, donc le risque d’infection. Pour l’homme, il existe l’étui pénien qui se fixe au niveau du pénis. Le problème principal de ce système étant la désadaptation voire l’impossibilité du maintien de l’étui. Pour la femme, il existe également un collecteur extérieur maintenu au niveau de la vulve par succion grâce à un système d’aspiration. Le problème principal de ce système est la nécessité de changer de collecteur toutes les huit à douze heures. Dans les deux cas, ces systèmes ne sont pas indiqués en cas de rétention aiguë d’urine, d’agitation du patient, ou d’incontinence anale chez la femme. Une étude prospective monocentrique réalisée dans un hôpital de soins aigus de 386 lits en Californie a montré l’intérêt du collecteur extérieur avec succion pour la diminution des IUAS sur matériel urinaire. L’utilisation d’une SV ou du collecteur était laissée au choix du personnel soignant après une formation spécifique. Le taux d’utilisation de SV était de 32% en 2015, puis 30% en 2016 et 26% et 2017. L’incidence des IUAS était de 1,11 pour 1 000 jours de matériel avant l’utilisation du collecteur contre 0 infection en 2016 (p=0,005) et 0,90 en 2017 (p=0,726) [12].
Formation à la pose, à l’entretien et au retrait dès que possible de la sonde urinaire
La mise en place de protocoles et de formations du personnel soignant à la pose, l’entretien, la fixation, et au suivi des patients avec SV a été bien étudiée et a montré son impact sur la réduction des IUAS [11,13,14,15]. Les règles de bonne pratique sont : respecter les indications de pose de SV ; effectuer une hygiène des mains immédiatement avant et après l’insertion ou toute manipulation du dispositif ou du site de la SV ; utiliser une technique aseptique et du gel lubrifiant à usage unique pour l’insertion ; utiliser une technique de sondage vésical adaptée ; fixer correctement la SV après sa mise en place pour éviter les mouvements et la traction sur le col vésical et le risque de retrait traumatique accidentel de la sonde ; maintenir la SV et le sac collecteur en système clos (même si cela a montré un impact seulement sur le risque de colonisation urinaire et non sur le risque d’infection urinaire) ; éviter l’obstruction ou le clampage de la SV ; maintenir le sac collecteur en déclive par rapport à la vessie ; vider le sac collecteur régulièrement, en évitant d’atteindre 75% du volume du sac ; retirer la SV dès que possible [14]. La mise en place de ce protocole dans une étude multicentrique internationale en réanimation a permis une diminution de 89% de l’incidence des IUAS sur une période de 39 mois [14]. La durée de port de SV étant un facteur de risque majeur d’IUAS, la réévaluation journalière de la nécessité de la SV et son retrait dès que possible sont essentiels, efficaces et faciles à mettre en place. Afin de faciliter cette réévaluation, il a été proposé une surveillance quotidienne de la SV par l’infirmière avec l’aide d’une check-list, et un possible retrait de la SV sur l’initiative de l’infirmière après accord du médecin. Il a également été proposé un rappel systématique aux médecins après 24 heures de pose de SV (grâce au logiciel de prescription informatique) pour valider le maintien de la SV ou la retirer. Il a également été étudié des systèmes de SV avec alerte colorimétrique directement sur le dispositif de recueil des urines, avec un changement de couleur en rouge dès que la sonde était posée depuis plus de 24 heures. Tous ces protocoles ont permis de réduire la durée de portage de la SV et l’incidence des IUAS [13,16]. Dans tous les cas, la mise en place d’un protocole est d’autant plus efficace qu’elle est suivie d’une formation du personnel, d’une évaluation régulière de son respect et de son efficacité, et du rappel régulier de son existence. En effet, on observe en France une hétérogénéité des connaissances du personnel paramédical sur le sujet. [17]. Le respect du protocole, et par conséquent l’amélioration des pratiques, est d’autant plus marqué que les formations sont répétées et que le personnel concerné a contribué à son élaboration. De plus, une équipe multidisciplinaire, comme on peut le voir dans les équipes opérationnelles d’hygiène, semble indispensable pour la surveillance des IUAS et l’amélioration des pratiques. Il a été rapporté que les conseils transmis ou les formations réalisés par une personne de manière transversale (infirmier vers infirmier, et médecin vers médecin) sont plus efficaces, ce qui souligne l’importance de la multidisciplinarité [14,18,19]. Les services d’hygiène et les équipes opérationnelles d’hygiène ont un rôle majeur à jouer dans la prévention des IUAS avec la mise en place, la mise à jour et le suivi de ces protocoles.
Pas d’examen cytobactériologique des urines systématique
En présence de SV, la distinction entre colonisation et infection est souvent difficile. En effet, la colonisation est quasi systématique après dix jours de SV, et les symptômes au niveau du bas appareil urinaire sont similaires en cas d’irritation liée à la SV et de réelle infection, le seul symptôme discriminant dans ce cas étant la survenue d’une fièvre. La prescription systématique d’examens cytobactériologiques des urines (ECBU) peut conduire à un traitement antibiotique inutile potentiellement toxique, et à une surestimation de l’incidence d’IUAS. Une étude monocentrique a montré une diminution de plus de 40% des IUAS chez les patients sondés après réalisation, mise en place et formation du personnel soignant à un protocole de réalisation d’ECBU [20] (Figure 1). Deux études récentes multicentriques rétrospectives confirment l’absence d’intérêt du traitement des bactériuries asymptomatiques pour prévenir les bactériémies, ainsi que l’absence d’intérêt du traitement des bactériuries asymptomatiques pré-opératoires pour prévenir le risque d’infection de site opératoire ou d’infection urinaire post-opératoire (hors chirurgie urologique) [21,22].
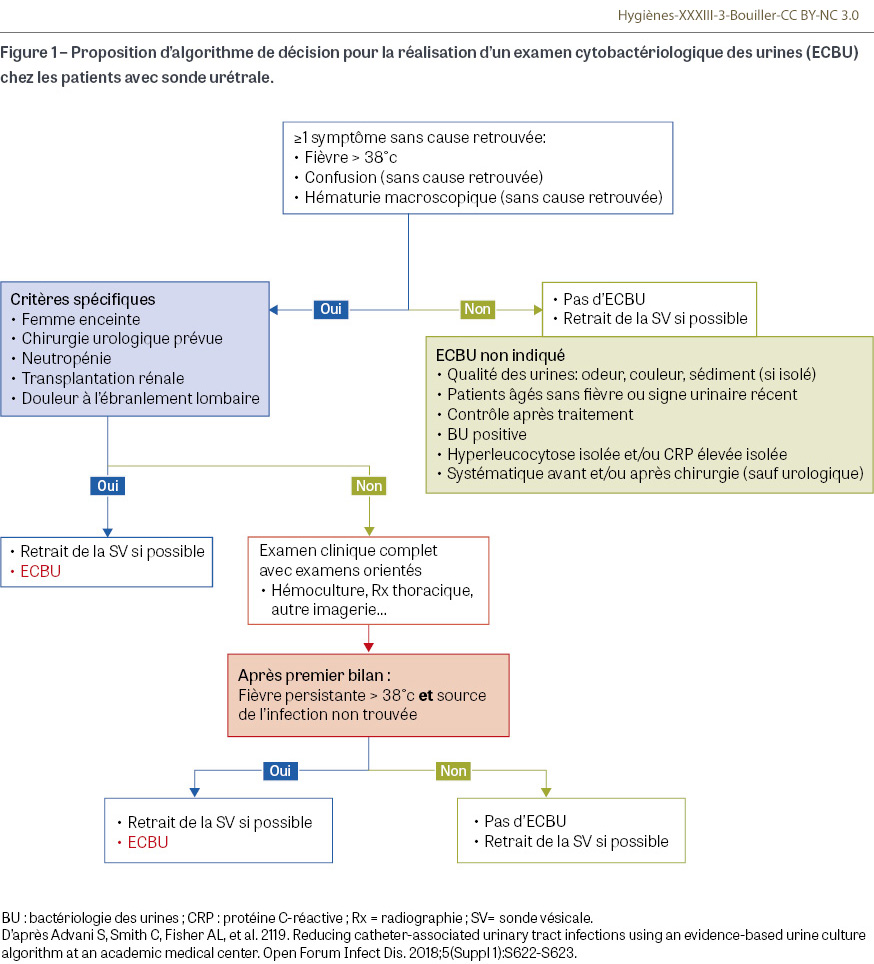
Nouveaux enjeux de la prévention
La plupart des moyens de prévention présentés ci-dessous sont encore en cours d’évaluation, soit avant leur commercialisation (comme la plupart des nouveaux cathéters), soit pour la validation de leur utilisation dans le cadre de la prévention des IUAS (comme les traitements immunologiques).
Nouveaux cathéters
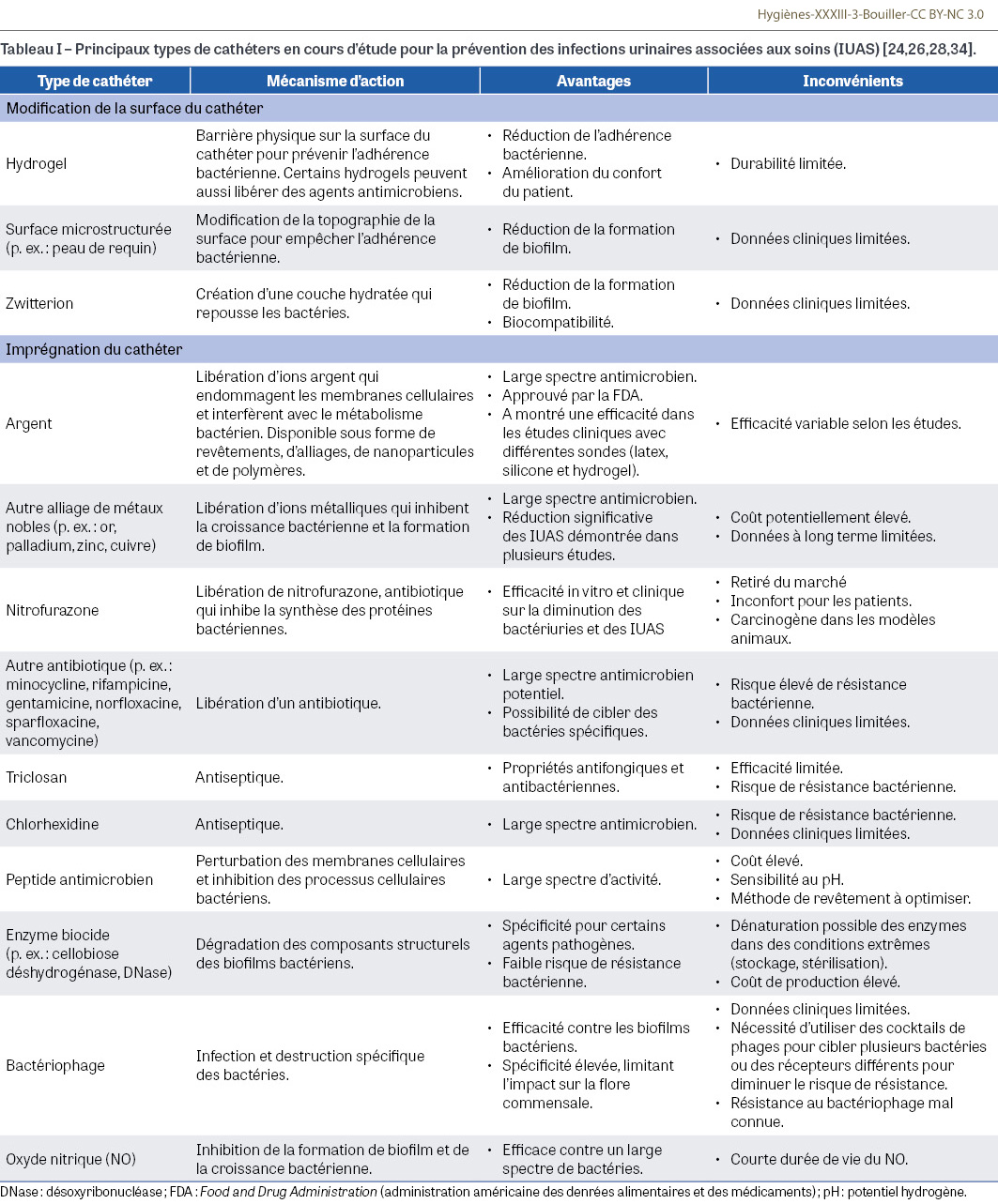
De nombreuses études sont consacrées au développement de nouveaux cathéters dotés de propriétés antimicrobiennes pour prévenir les IUAS [23,24,25,26,27,28]. Ceux-ci ciblent différentes phases du mécanisme infectieux (Tableau I).
Prévention de l’adhérence bactérienne
Les revêtements de surface avec des alliages de métaux nobles (p. ex. : argent, or, palladium) libèrent des ions métalliques qui inhibent la croissance bactérienne et la formation de biofilm. Les hydrogels créent une barrière physique sur la surface du cathéter, limitant l’adhérence bactérienne. Les surfaces microstructurées imitent les structures naturelles (p. ex. : peau de requin) pour empêcher l’adhérence bactérienne. Les zwitterions, des molécules avec des charges positives et négatives, créent une couche d’eau qui repousse les bactéries [23,24,25,26,27,28]. Les bactériophages sont des virus qui infectent et se répliquent à l’intérieur des bactéries. Ils ont été étudiés pour leur capacité à réduire la formation de biofilm dans un modèle préclinique de biofilm sur cathéter. Des cathéters enduits d’un hydrogel contenant des cocktails de phages ciblant Pseudomonas aeruginosa et Proteus mirabilis ont montré une réduction significative du biofilm (diminution du compte de biofilm de 4 log10 UFC1/cm2, p≤0,01 pour P. aeruginosa et >2 log10 UFC/cm2, p≤0,01 pour P. mirabilis) après 48 heures [29]. D’autres études avec le même modèle ont rapporté l’efficacité des phages dans la réduction du biofilm d’Escherichia coli et de Staphylococcus epidermidis [30,31]. Une autre méthode originale utilisant un revêtement de surface sensible au pH2 pour la libération de bactériophages, dans le but de prévenir l’obstruction des cathéters urinaires causée par Proteus mirabilis, a été étudiée in vitro. L’augmentation du pH causée par P. mirabilis déclenche la libération de bactériophages du revêtement. Une réduction significative (environ 6 log10) de la concentration de P. mirabilis a été observée après l’activation du revêtement et le temps nécessaire à l’obstruction du cathéter était doublé avec les cathéters revêtus de phages par rapport aux cathéters non revêtus (de 13 h à 26 h) [32]. Des travaux supplémentaires sont nécessaires concernant l’utilité et la sécurité des bactériophages pour la prévention des IUAS. Compte tenu de leur spécificité et des multiples bactéries responsables d’IUAS, l’utilisation d’un cocktail de bactériophages pourrait s’avérer une approche prometteuse.
Action antimicrobienne directe
Les cathéters imprégnés d’antibiotiques libérés localement détruisent ou inhibent la croissance des bactéries. Les peptides antimicrobiens perturbent les membranes cellulaires bactériennes et possèdent un large spectre d’activité. Les enzymes biocides, comme la cellobiose déshydrogénase, dégradent les biofilms bactériens. L’oxyde nitrique inhibe la formation de biofilm et la croissance bactérienne [23,24,26,27,28].
Amélioration de la conception du cathéter
De nouvelles sondes ont été conçues notamment pour améliorer le drainage des urines, comme les cathéters à ballon asymétrique, qui visent à réduire la stagnation des urines, diminuant ainsi le risque d’infection [33]. Plusieurs études cliniques ont démontré l’efficacité des cathéters antimicrobiens, notamment ceux recouverts d’alliages de métaux nobles, pour réduire l’incidence des IUAS. Une méta-analyse regroupant les études entre 2000 et 2022, a montré que les cathéters en silicone ou en latex imprégnés d’argent étaient associés à une moindre incidence d’IUAS (odd ratio [OR]=0,67 ; IC95 [0,55-0,83] et OR=0,72 ; IC95 [0,64-0,82], respectivement). Cependant, il existait une grande hétérogénéité dans les études analysées, ce qui rend les résultats difficiles à interpréter [34]. Une étude publiée en 2024 a également montré que les cathéters à hydrogel imprégnés d’argent étaient responsables de moins d’infections urinaires au bout de sept jours de port (J7) par rapport à un cathéter conventionnel (22,1% vs 7,8%, p=0,023) [35]. Les principales limites à l’utilisation des nouveaux cathéters sont le risque de développement d’une résistance aux antibiotiques utilisés sur les cathéters, leur coût (des études d’analyse coût-efficacité sont nécessaires pour évaluer leur rapport coût/bénéfice), et leur durabilité et leur biocompatibilité (la durabilité des revêtements antimicrobiens et leur impact sur la biocompatibilité à long terme doivent être évalués). En conclusion, l’utilisation de nouveaux cathéters antimicrobiens représente une avancée majeure pour la prévention des IUAS. Cependant, des défis persistent, notamment le risque d’émergence de résistances aux antibiotiques et les coûts. Devant l’ampleur de la résistance bactérienne aux antibiotiques, l’intérêt des cathéters imprégnés d’antibiotique (voire d’antiseptique) est très limité.
Interférence bactérienne
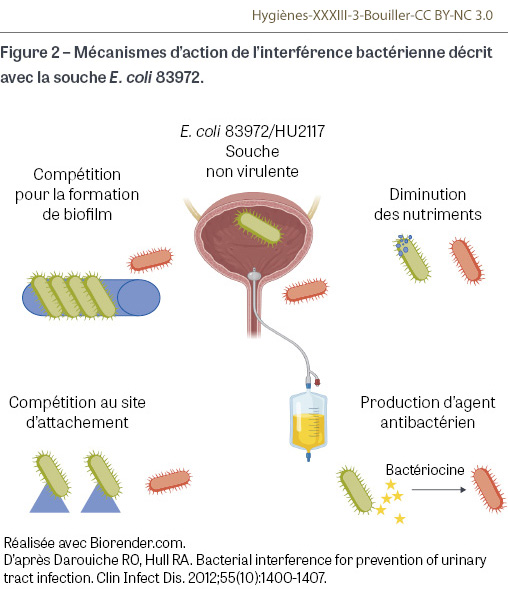
L’interférence bactérienne est une méthode originale de prévention basée sur l’utilisation d’une souche d’E. coli non virulente qui entre en compétition avec la souche pathogène et éviterait ainsi l’infection. Cette approche a été étudiée avec des souches d’E. coli 83972 et HU2117. La souche d’E. coli 83972, isolée de bactériurie asymptomatique, présente le gène pap3 chromosomique responsable de la synthèse de P fimbriae mais qui est généralement non exprimé. Plus récemment, a été utilisée la souche E. coli HU2117 qui est une souche génétiquement modifiée créée à partir d’E. coli 83972 de type sauvage qui présente une mutation de délétion de 800 paires de bases dans le gène chromosomique papG. Leur mode d’action passe par la diminution des nutriments utilisés par la bactérie non virulente ce qui les rend indisponibles pour la potentielle bactérie virulente, par la production de composés antibactériens et notamment de bactériocines contre la bactérie pathogène, par la compétition au site d’attachement de la bactérie et par la disruption et la compétition de la formation de biofilm (Figure 2) [36]. Cette approche a montré son intérêt dans une étude portant sur treize patients ayant une vessie neurologique et une SV intermittente. Huit patients étaient colonisés six semaines après l’injection de la souche, avec une diminution du taux d’IUAS de 2,27 à 0,77 IUAS par patient-année [37]. Une étude similaire a été réalisée chez les patients avec SV au long cours mais n’a pas montré de différence avant, pendant ou après la colonisation par la souche E. coli HU2117. De plus, chez un patient ayant développé une IUAS, la bactérie retrouvée était la souche expérimentale HU2117, ce qui pose la question de l’utilisation dans l’avenir de souches totalement non virulentes et efficaces [38]. Un essai randomisé et contrôlé a inclus des patients adultes avec vessie neurologique et infection urinaire récidivante sur SV. Chez les patients dont les cultures d’urine étaient positives, un traitement antibiotique a d’abord été administré et les sondes ont été changées avant l’inoculation de la souche E. coli HU2117 par un cathéter. L’opération était répétée deux fois au cours de trois jours successifs. Le nombre moyen d’infections urinaires symptomatiques était plus faible dans le groupe E. coli HU2117 que dans le groupe témoin, et E. coli HU2117 n’a pas provoqué d’infection urinaire symptomatique dans cette étude [39]. Les recherches actuelles visent à améliorer l’adhérence de la souche E. coli 83972 notamment en modifiant les gènes responsables de la production de pili de type 1 et en augmentant ainsi son adhérence à l’épithélium urinaire. L’autre perspective de recherche est de pouvoir imprégner les cathéters avec la souche E. coli 83972 afin de préformer du biofilm et de réduire l’adhérence des autres bactéries sur le cathéter [28]. Les principales limites de cette technique sont le coût de la procédure, la période d’instillation nécessaire et la difficulté d’implantation de la souche non pathogène.
Vaccination
La vaccination (ou plutôt immunothérapie) contre les infections urinaires est une stratégie de prévention intéressante pour limiter la consommation d’antibiotiques donc l’antibiorésistance. Bien que la plupart des études se soient concentrées sur la prévention des infections urinaires récidivantes non compliquées, leur utilisation dans la prévention des IUAS est prometteuse. En effet, les vaccins actuellement en développement ciblent plus spécifiquement E. coli et Enterococcus spp., qui sont également les organismes les plus fréquemment responsables d’IUAS. Il est attendu que les exigences fixées à l’égard d’un vaccin contre les infections urinaires soient les mêmes que celles retenues à l’égard d’un vaccin standard, soit une spécificité du pathogène (c’est-à-dire, dans le cadre des IU, une activité spécifique sur les pathogène urinaires), une antigénicité et une production d’anticorps optimale empêchant l’infection. Un vaccin devrait donc déclencher une réponse immunitaire humorale et cellulaire robuste lors de la pénétration d’une bactérie dans l’uro-épithélium. Cependant, malgré l’intérêt que ces produits suscitent, leur mécanisme d’action reste pour l’instant mal décrit. L’OM-89 (Uro-Vaxom®, OM Pharma, Myerlin, Suisse) est un cocktail lyophilisé de protéines membranaires de 18 souches uropathogènes d’E. coli. Dans le cadre d’une cystite récidivante, il est administré par voie orale à la posologie d’une capsule par jour pendant trois mois, puis trois mois plus tard dix capsules par mois pendant encore trois mois. Une méta-analyse sur la prise en charge des cystites récidivantes a montré une diminution du nombre moyen d’infections urinaires chez les patients traités par l’OM-89 par rapport aux témoins sous placebo (0,63±1,03 vs 0,98±1,29, p<0,001), ainsi que de l’utilisation d’antibiotiques pendant une période de six à douze mois (0,85±1,65 vs 2,78±4,40, p<0,001) [40]. Un essai de supériorité randomisé multicentrique en double aveugle est en cours en France chez les patients avec vessie neurologique en autosondage ayant pour objectif principal de comparer le nombre de traitements antibiotiques pour infection urinaire (IU) pendant un an (NCT06588010). Le vaccin MV-140 (Uromune, Syner-Med, Londres, Royaume-Uni, et Immunotek Madrid, Espagne) est composé de lysats cellulaires inactivés de plusieurs uropathogènes (E. coli, K. pneumoniae, P. vulgaris et E. faecalis). Ce vaccin a la particularité d’être administrable en pulvérisation sublinguale. La posologie usuelle est de deux pressions du produit par voie sublinguale par jour pendant trois mois. Dans une étude prospective incluant 77 femmes avec IU récidivante, 78% n’avaient pas eu d’IU au cours de la période de surveillance de douze mois suivant les trois mois de vaccin [41]. Une autre étude prospective monocentrique ouverte a inclus 648 patientes ayant une IU récidivante et recevant le vaccin MV-140. L’âge moyen des patientes était de 72 ans. L’efficacité globale définie par un nombre d’infections urinaires <2 durant le suivi était de 96%, 88% et 56% après respectivement trois, six et douze mois de suivi, avec une efficacité plus importante pour les patientes qui avaient moins de cinq infections urinaires par an à l’inclusion [42]. Un essai clinique de phase III, randomisé, contrôlé contre placebo et en double aveugle chez 240 femmes ayant une IU récidivante a montré une réduction du nombre médian d’infections urinaires au cours des neuf mois suivant la vaccination par rapport au placebo (0 dans le groupe traité contre 3 dans le groupe placebo) [43]. L’immunoprophylaxie fait partie des recommandations de l’Association européenne d’urologie (EAU) dans la prise en charge des infections urinaires récidivantes de la femme (recommandation forte) mais elle n’est pas disponible en France [44]. Ces données sont encourageantes pour la prévention des IUAS, mais nécessitent d’être consolidées notamment chez les patients avec SV. D’autres vaccins immunostimulants, généralement des lysats cellulaires multisouches, sont en cours de développement. Leurs formulations sont vaginales, parentérales et orales, mais la plupart n’ont pas été testées dans le cadre d’un essai clinique de phase III [45,46].
Autres
La canneberge (cranberry en anglais) a un mode d’action basé sur la perturbation de l’adhérence des bactéries à l’uro-épithélium [47]. Une revue Cochrane de 2023 a montré un intérêt de la canneberge pour la réduction des infections urinaires (6 211 participants : risque relatif [RR]=0,70 ; IC95 [0,58-0,84] ; I24=69%). Plus spécifiquement dans le cadre des IUAS, la canneberge réduit les IUAS post-chirurgie à risque (6 études, 1 434 participants : RR=0,47 ; IC95 [0,37-0,61] ; I2=0%). Par contre elle n’a pas démontré son intérêt chez les patients âgés avec trouble de la vidange vésicale et chez les femmes enceintes [48]. Il n’y a pas pu avoir de conclusion sur l’efficacité selon la forme sous laquelle elle est ingérée (jus ou gélule), et sur les différents dosages de canneberge.
La méthénamine est un antiseptique hydrolysé en ammoniac et en formaldéhyde ayant des propriétés bactéricides non spécifiques [49]. Il existe des preuves de l’efficacité de la méthénamine comme prophylaxie des IUAS chez les personnes avec SV. Il a été démontré que la méthénamine diminuait le risque de bactériurie à J7 et J14 par rapport aux patients contrôles (39% vs 79%, et 77% vs 100% respectivement) et réduisait l’incidence des IUAS dans une population de patients avec SV dans une étude avant/après (18,2% d’IUAS sous traitement vs 77,3% sans traitement) [49]. Elle a également été étudiée en prévention d’IUAS post-chirurgie : chirurgie gynécologique avec laparotomie et plastie vaginale avec pose de SV (taux d’IUAS post-opératoire de 2,7% dans le groupe traitement vs 13,9% dans le groupe placebo, p=0,003), et en chirurgie par prostatectomie (taux d’IUAS de 40% pour le groupe méthénamine vs 33% pour le groupe nitrofurantoïne, 53% pour le groupe cotrimoxazole et 67% pour le groupe sans traitement) [49]. Elle est contre-indiquée chez les personnes souffrant d’insuffisance rénale chronique ou d’insuffisance hépatique grave. Elle n’est pas disponible en France.
Le D-mannose est un monosaccharide qui inhibe l’adhérence bactérienne à l’uro-épithélium en bloquant le site de liaison de FimH5. Malgré un mécanisme d’action bien compris, il existe des preuves limitées de son utilité dans la prévention des IUAS. Dans une étude incluant des patients atteints de sclérose en plaques et d’infections urinaires récidivantes, la prise de D-mannose deux fois par jour pendant seize semaines a été associée à une diminution des infections urinaires que ce soit chez les patients avec SV intermittente sus-pubienne ou chez les patients sans SV (diminution de 63% ; IC95 [0,67-0,25] et 75% ; IC95 [0,5-0,12] respectivement, p<0,01) [50]. À noter que, dans une étude récente multicentrique randomisée contre placebo sur la prévention des cystites récidivantes de la femme, le taux de nouvelle consultation pour suspicion de récidive d’IU n’était pas différent dans les deux groupes (51% dans le groupe D-mannose vs 56% dans le groupe placebo, p=0,26). Même si cette étude ne s’intéresse pas directement aux IUAS, elle met en doute l’efficacité de ce traitement [51].
Concernant les probiotiques (lactobacillus spp.), un essai clinique randomisé et contrôlé portant sur 207 patients avec vessie neurologique dont 60% avec SV n’a pas montré de différence dans la prévention des IUAS par rapport au placebo (HR6=0,67 ; IC95 [0,39-1,18] ; p=0,17) [52]. Une série de cas a montré un changement significatif dans la composition du biofilm sur cathéters après l’administration de probiotiques [53]. La possibilité d’utiliser les probiotiques en tant qu’adjuvant pour la prévention des IUAS doit être étudiée.
En phytothérapie, le Canephron® fabriqué par le laboratoire Bionorica (Neumarkt in der Oberpfalz, Allemagne) et commercialisé en France par le laboratoire Boiron (Messimy, France) bénéficie d’une autorisation de mise sur le marché depuis 2020 pour la cystite simple. Il contient de la poudre de petite centaurée, de racine de livèche et de feuille de romarin. Il a des propriétés anti-inflammatoires, spasmolytiques, anti-adhésives, antalgiques et diurétiques [54]. Une étude comparant le Canephron® pendant trois semaines à de la ciprofloxacine pendant trois jours après une chirurgie de pose de bandelette sous-urétrale a montré un taux d’infections urinaires à six mois semblable entre les deux groupes (13,6% vs 11%) [55]. Des essais cliniques supplémentaires sont nécessaires pour déterminer si un traitement par phytothérapie est efficace pour la prévention des IUAS.
L’irrigation (lavage) a pour but de prévenir le blocage de la SV et les IUAS. Cependant, les preuves concernant les avantages et les risques de cette pratique sont limitées. Une revue Cochrane réalisée en 2017 a conclu que les sept essais inclus étaient limités et généralement de mauvaise qualité [56]. Les preuves n’étaient pas suffisantes pour recommander ou non le lavage. Les études examinées étaient hétérogènes, utilisant différentes solutions d’irrigation (solution saline ou solution acide, gentamicine, bétadine) et différents protocoles. Bien que certaines études suggèrent un bénéfice potentiel de l’irrigation des SV, les preuves restent limitées et des recherches supplémentaires sont nécessaires pour déterminer son efficacité et les solutions les plus appropriées.
Conclusion
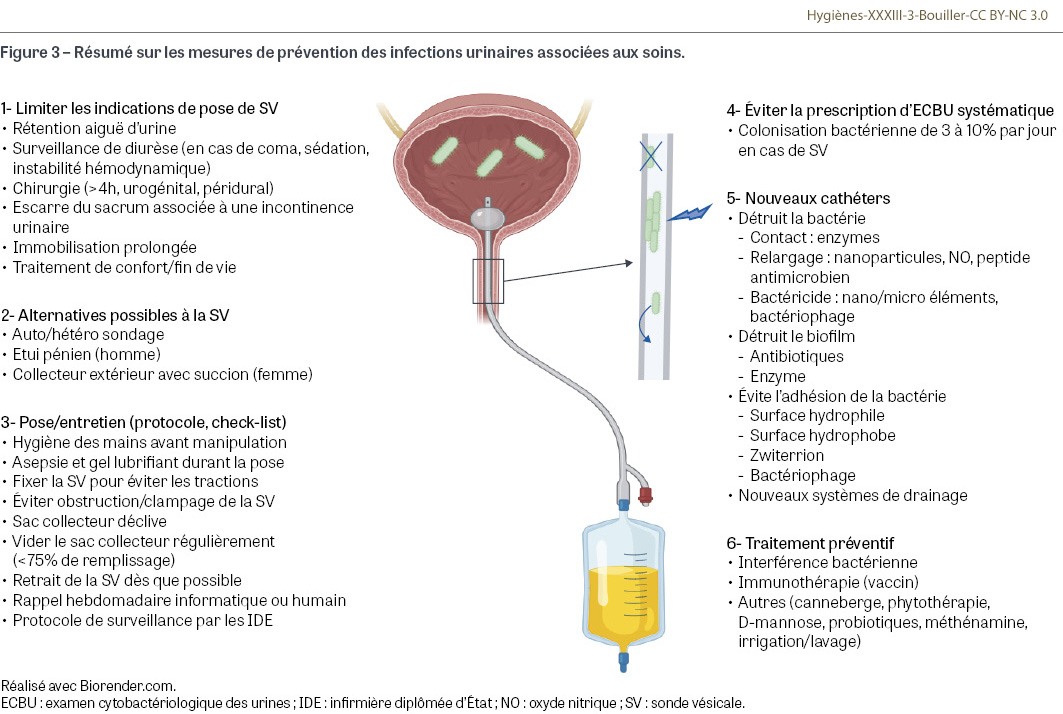
Les IUAS représentent un défi majeur de santé publique en termes de morbidité et de mortalité, particulièrement en raison de la résistance croissante aux antibiotiques à laquelle elles participent. Les facteurs de risque tels que le port prolongé de SV contribuent largement à leur développement. La prévention des IUAS repose principalement sur l’apprentissage d’une bonne technique de pose, sur la gestion optimale des sondes urinaires, y compris la réduction de leur utilisation, et sur l’amélioration des pratiques de soin, notamment par la formation du personnel et l’instauration de protocoles rigoureux (Figure 3). L’innovation comprenant la création de nouveaux cathéters et les avancées en matière de traitements préventifs, comme les vaccins et l’interférence bactérienne, offrent des perspectives prometteuses pour réduire l’incidence des IUAS (Figure 3). Toutefois, ces nouvelles options préventives se heurtent à des défis liés à leur coût, ainsi qu’à la durabilité et à l’innocuité des matériaux. Ainsi, bien que des progrès significatifs aient été réalisés dans la prévention, la gestion des IUAS demeure un enjeu complexe qui nécessite une approche pluridisciplinaire, l’intégration de nouvelles technologies, et un engagement continu en matière de formation et de protocoles de soins.
Notes :
1- Unité formant colonie.
2- Potentiel hydrogène.
3- Pili associés à la pyélonéphrite.
4- Indicateur d’hétérogénéité (inconsistency, incohérence).
5- Adhésine de pointe des fimbriae de type 1 spécifiques du mannose d’Escherichia coli.
6- Hazard ratio, risque relatif.